
【题目】可逆反应A(g)+B![]() C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
A.若B是气体,增大A的浓度会使B的转化率增大
B.若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C.升高温度,C质量分数减少,说明正反应为放热反应
D.增大压强,平衡不移动,说明B、D一定是气体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知一定温度下,2X(g)+Y(g) ![]() mZ(g) ΔH=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
mZ(g) ΔH=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
A. m = 4 B. a = b C. a < ![]() D. m < 3
D. m < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂每小时生产a 吨98%(质量分数)硫酸。为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为___________m3。
(2)为满足题设要求,b%的下限等于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合![]() 常数,下列说法错误的是
常数,下列说法错误的是![]()
![]()

A.图中温度![]()
B.图中五点![]() 间的关系:
间的关系:![]()
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将![]() 的硫酸溶液与
的硫酸溶液与![]() 的KOH溶液等体积混合后,溶液显碱性
的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______。
(2)烧杯间填满碎纸条的作用是_________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热_______(填“相等、不相等”),简述理由________。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
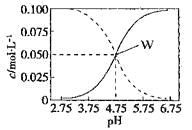
A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。(请填写元素符号)
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的最外层电子构型____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中,保持一定的温度发生下列反应:4A(g)+B(?)2C(g)+2D(g),请用“增大”“减小”“不变”或“能”“不能”填空。
(1)当B为固体时,若反应向右进行,容器内混合气体的密度___________;若反应向左进行,容器内混合气体的密度___________;当容器内混合气体的密度不变时___________说明反应已经达到平衡。
(2)当B为气体时,不论向哪个方向反应,容器内混合气体的密度___________,故当容器内混合气体的密度不变时___________说明反应已经达到平衡。
(3)当B为固体时,无论向哪个方向反应,容器内混合气体的压强___________,故当容器内混合气体的压强不变时___________说明反应已经达到平衡。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com