
(18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。
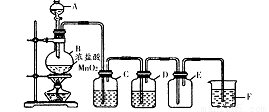
仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl2与FeBr2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol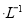 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl2先将Fe2+氧化生成Fe3+,溶液逐渐变黄色,Cl2再把Br-氧化成Br2,溶液变为棕黄色。
假设2:Cl2先将Br-氧化生成Br2,溶液逐渐变黄色,Cl2再把Fe2+氧化成Fe3+,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl2、Fe3+、Br2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,写出反应的离子方程式:________ 。
(18分)
(1)分液漏斗(1分) 饱和食盐水(2分) 除去尾气中的氯气防止污染空气(2分)
MnO2+4H++2Cl? Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)①取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。(3分)或取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。(3分)
②取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置(2分) Cl2 > Br2 >Fe3+(2分)
假设1(1分)
(3)2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?(3分)
【解析】
试题分析:(1)根据实验装置图,仪器A的名称为分液漏斗;MnO2与浓盐酸反应制取的氯气中含有HCl和水分,所以装置C中的试剂是饱和食盐水,作用是吸收HCl杂质;氯气有毒,不能排放到大气中,所以装置F的作用是:除去尾气中的氯气防止污染空气;MnO2与浓盐酸反应生成MnCl2、Cl2、H2O,离子方程式为:MnO2+4H++2Cl? Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)①根据假设①设计实验方案,应检验溶液中是否含有Fe3+,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。根据假设②设计实验方案,应检验溶液中是否含有Br2,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。
②实验现象为:CCl4层由无色变为橙色,说明生成了Br2,应加入Cl2,所以实验操作为:取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置;根据氧化剂的氧化性大于氧化产物的氧化性可得氧化性由强到弱的顺序为:Cl2 > Br2 >Fe3+;还原性由强到弱的顺序为:Fe2+ > Br? > Cl?,所以Cl2先氧化还原性强的Fe2+,故假设①合理。
(3)向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,Cl2先氧化0.1mol Fe2+,消耗Cl2 0.05mol,剩余的0.05mol Cl2再氧化0.1mol Br?,所以离子方程式为:2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?
考点:本题考查基本仪器和基本操作、实验方案的设计与分析、离子方程式的书写。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
对尼古丁和苯并[a]芘的分子组成与结构描述正确的是( )

A.尼古丁的分子式为C10H12N2
B.尼古丁为芳香族化合物
C.苯并[a]芘分子中含有苯环结构单元,
是苯的同系物
D.尼古丁分子中的所有氢原子一定不在同一平面上,苯并[a]芘分子中所有氢原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
化学与人类生活密切相关,下列与化学有关的说法正确的是
A.化学药品着火,都要立即用水或泡沫灭火器灭火
B.开发和推广新能源是实现低碳生活的途径之一
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:实验题
(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
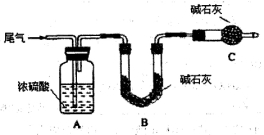
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:选择题
有机物W(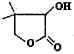 )常用于合成维生素类药物。下列与W相关说法正确的是
)常用于合成维生素类药物。下列与W相关说法正确的是
A.分子式为C6H9O3
B.分子中含有2种官能团
C.分子中含有6种不同化学环境的氢原子
D.水溶液中lmolW可与3molNaOH完全反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:简答题
(10分)乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
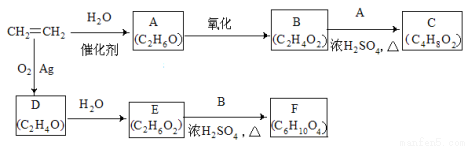
请回答下列问题:
(1)A的化学名称是 。
(2)B和A反应生成C的化学方程式为 ,该反应的类型为 。
(3)D为环状化合物,其结构简式为 。
(4)F的结构简式为 。
(5)D的同分异构体的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为
A.0.5molB.2molC.2.5molD.4mol
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:实验题
(18分)氨、氯气和溴是中学化学实验中的常见试剂:
(1)实验室利用反应:2NH3+3CuO N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。
N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。
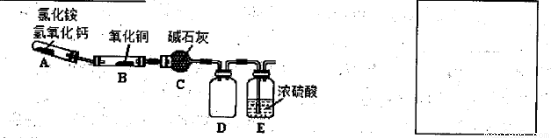
上述装置设计尚存在缺陷,应在 (填上述仪器字母序号)之间再加一个装置,请画出该装置(注明所需试剂)。
(2)实验室用Cl2从盐湖苦卤(富含K+、Ca2+、Mg2+、Br-、SO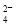 、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:
、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:
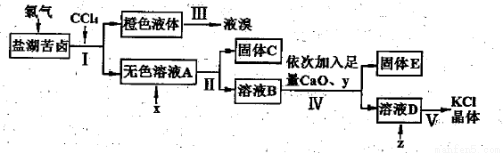
①步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为 。
②加入试剂x的目的是 ;步骤Ⅳ中试剂y的化学式为 ;
③步骤v中蒸发溶液D时需要的仪器除酒精灯、三脚架外还需 。
(3)Br2和FeCl3的稀溶液均呈黄色。将少量稀溴水滴入稀FeCl2溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,则二者未发生化学反应。该实验设计不正确,错误在于____ 。设计合理实验检验溴水和FeCl2溶液是否发生化学反应(简要说明实验步骤、现象和结论) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com