
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
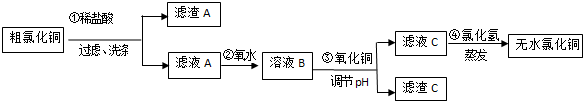
分析 粗制的氧化铜粉末(含FeO和SiO2杂质),加入盐酸,CuO+2HCl═CuCl2+H2O,FeO+2HCl═FeCl2+H2O,二氧化硅和盐酸不反应,滤渣A为SiO2,滤液A为:CuCl2、FeCl2,加氯水,氯气具有氧化性氧化亚铁离子2Fe2++Cl2=2Fe3++2Cl-,滤液B为:Fe3+、Cu2+、Cl-,加入氧化铜,氧化铜和氢离子反应,Fe3++3H2O?Fe(0H)3+3H+,调节PH至3.2,形成氢氧化铁沉淀,氯化铜水溶液中铜离子水解,在氯化氢气流中加热抑制氯化铜水解得到氯化铜固体,
(1)第②步加入氯水,氯气氧化亚铁离子;
(2)粗制的氧化铜粉末(含FeO和SiO2杂质),加入盐酸,氧化亚铁、氧化亚铜和酸反应生成易溶于水的盐,二氧化硅和酸不反应,难溶于水,Fe3+与硫氰化钾溶液反应,使溶液变红色,据此解答;
(3)根据蒸发操作所用的仪器分析判断,蒸发需要蒸发皿、酒精灯、玻璃棒等仪器;氯化铜水溶液中铜离子水解,在氯化氢气流中加热抑制氯化铜水解;
(4)Fe+2Fe3+=3Fe2+,铁和氯化铜反应Fe+Cu2+=Fe2++Cu生成氯化亚铁和铜,根据n=cV计算25mL样品溶液消耗高锰酸钾的物质的量,进而计算250mL溶液可以消耗高锰酸钾的物质的量,再根据5Fe2++MnO4-+8H+=5Fe3++2Mn2++4H2O离子方程式计算亚铁离子的物质的量,亚铁离子总量减去三价铁转化的铁离子可得由无水CuCl2转化的亚铁离子,根据铁守恒可得产品中CuCl2的物质的量,根据m=nM计算CuCl2的质量,进而计算其质量分数;
解答 解:粗制的氧化铜粉末(含FeO和SiO2杂质),加入盐酸,CuO+2HCl═CuCl2+H2O,FeO+2HCl═FeCl2+H2O,二氧化硅和盐酸不反应,滤渣A为SiO2,滤液A为:CuCl2、FeCl2,加氯水,氯气具有氧化性氧化亚铁离子2Fe2++Cl2=2Fe3++2Cl-,滤液B为:Fe3+、Cu2+、Cl-,加入氧化铜,氧化铜和氢离子反应,促进水解反应右移,Fe3++3H2O?Fe(0H)3+3H+,调节PH至3.2,形成氢氧化铁沉淀,氯化铜水溶液中铜离子水解,在氯化氢气流中加热抑制氯化铜水解得到氯化铜固体,
(1)氯气具有氧化性,亚铁离子具有还原性,第②步加入氯水,发生反应2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)粗制的氧化铜粉末(含FeO和SiO2杂质),加入盐酸,CuO+2HCl═CuCl2+H2O,FeO+2HCl═FeCl2+H2O,二氧化硅和盐酸不反应,CuCl2、FeCl2易溶于水,二氧化硅和酸不反应,难溶于水,所以滤渣A为SiO2,Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验滤液B中是否含Fe3+离子的方法为:取少量滤液C,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:SiO2;取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽;
(3)蒸发时,需要使用蒸发皿;需要铁架台和铁圈支撑蒸发皿;需要玻璃棒进行搅拌,以防止液体受热不均匀,造成液体飞溅;需要酒精灯进行加热;坩埚钳用于夹持蒸发皿,滤液C是氯化铜溶液,制取无水CuCl2时,需在HCl气体中蒸干是防止氯化铜水解,HCl抑制CuCl2水解;
故答案为:酒精灯、蒸发皿、玻璃棒;HCl抑制CuCl2水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉,Fe+Cu2+=Fe2++Cu,Fe+2Fe3+=3Fe2+,用0.100mol•L-1酸性KMnO4溶液滴定5Fe2++MnO4-+8H+=5Fe3++2Mn2++4H2O,25mL样品溶液消耗高锰酸钾的物质的量为0.046L×0.100mol/L=4.6×10-3mol,可知250mL溶液可以消耗高锰酸钾的物质的量为4.6×10-3mol×$\frac{250mL}{25mL}$=4.6×10-2mol,由5Fe2++MnO4-+8H+=5Fe3++2Mn2++4H2O,可知250mL溶液中亚铁离子离子的物质的量为4.6×10-2mol×5=0.23mol,由Fe+2Fe3+=3Fe2+,三价铁转化的铁离子0.0204mol×$\frac{3}{2}$=0.0306mol,Fe+Cu2+=Fe2++Cu可得无水CuCl2产品中CuCl2的物质的量为0.23mol-0.0306mol=0.1994mol,故CuCl2的质量分数为$\frac{0.1994mol×135g/mol}{30.250g}$≈0.89,
故答案为:0.89;
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写离子方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力,注意(4)滴定的计算.


科目:高中化学 来源: 题型:解答题
 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
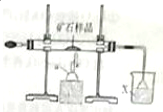 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、Na+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ca2+、H+、S2-、ClO- | D. | H+、Cl-、Fe2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com