
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
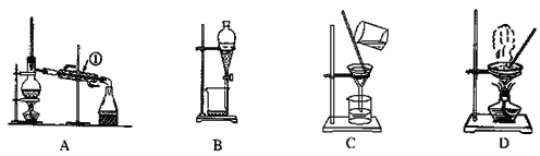
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_______。
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从_______(填“上”或“下”)口进水。装置B在分液时上层液体从___________(填仪器名称)的___________(填“上”或“下”)口流出。
【答案】D A B 分液 冷凝管 下 分液漏斗 上
【解析】
装置A是蒸馏装置,常用于分离多种沸点相差较大的液态物质,也可用于分离液体和不挥发性溶质,装置B是分液装置,常用于分离互不相溶的两种液体,装置C是过滤装置,可以除去液体中的固体杂质,装置B是蒸发装置,可以从溶液中获得不挥发性溶质,据此来分析即可。
(1)从溶液中获得不挥发性溶质,可以选用蒸发装置,即D;若要除去![]() 这种不挥发的杂质,可以选用蒸馏装置,即A;
这种不挥发的杂质,可以选用蒸馏装置,即A;
(2)油和水互不相溶,选择分液装置即可,即B;
(3)①的名称是冷凝管,冷凝水的方向要与蒸气的方向相反来获得最佳的冷凝效果,因此要从下口进水,上口出水;而分液时,上层液体从分液漏斗的上口流出,下层液体从分液漏斗的下口流出。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)用氧化物的形式表示硅酸盐的组成,钙沸石Ca(Al2Si3O10)·3H2O表示为___。
(2)氢氟酸可刻蚀玻璃,反应的化学方程式为___。
(3)工业上使用漂白粉时常向其中加入稀盐酸,化学方程式为___。
(4)将钠、镁、铝各0.4mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积比为___。
(5)向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示,若由于碱过量,最终产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积是___mL。

(6)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过一定量Na2O2后,气体体积变为原体积的![]() (同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
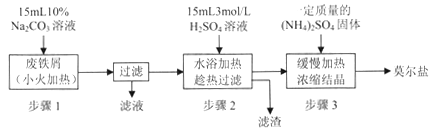
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
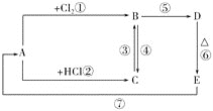
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与11.7g Na2O2中氧原子数相等的是( )
A.5.6g COB.4.4g CO2C.8g SO3D.9.8g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。

a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则

①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铝铁合金,加入到足量氢氧化钠溶液,滤出不溶物洗涤后再用一定量盐酸恰好完全溶解,继续在溶液中加入足量氨水,在空气中静置至红褐色沉淀不再增加为止,将沉淀滤出再灼烧至恒重,得到残留 固体的质量与原合金的质量相同,则:
(1)合金溶于足量氢氧化钠溶液所得溶液中含有的阴离子有______ 、_______ ;
(2)沉淀滤出再灼烧至恒重,得到残留固体的化学式为____________________;
(3)合金中铝的质量分数为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a表示放热反应 X(g) + Y(g)![]() Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
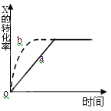
A.升高温度B.加大X的投入量C.加催化剂D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,工作原理如图所示,其中各电极未标出。下列有关说法错误的是( )

A.A池中右边加入NaOH溶液的目的是增大溶液的导电性
B.两池工作时收集到标准状况下气体X为2.24L,则理论上此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为5.6L
C.A为阳离子交换膜、B为阴离子交换膜
D.氢氧化钠的质量分数从大到小的顺序为b%>a%>c%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com