
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
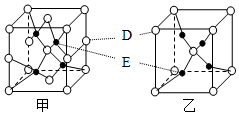 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| a | CO2 | Al(OH)3 | H2SO4 | HNO3 |
| b | Na2CO3 | NaAlO2 | SO2 | NO |
| c | NaHCO3 | Al2O3 | SO3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (4)(5) | C. | (1)(2)(5) | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com