
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
分析 A.乙酸乙酯与氢氧化钠溶液反应生成乙酸钠和乙醇;
B.Ag(NH3)2OH应写成离子的形式;
C.向苯酚钠溶液中通入少量的CO2生成碳酸氢钠和苯酚;
D.甘氨酸含有羧基,可与氢氧化钠发生中和反应.
解答 解:A.乙酸乙酯与氢氧化钠溶液反应生成乙酸钠和乙醇,正确的离子方程式为CH3COOC2H5+OH-→CH3COO-+C2H5OH,故A错误;
B.Ag(NH3)2OH应写成离子的形式,应为为CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故B错误;
C.苯酚酸性比碳酸氢钠强,比碳酸弱智,则向苯酚钠溶液中通入少量的CO2生成碳酸氢钠和苯酚,反应的离子方程式为CO2+H2O+C6H5O-→C6H5OH+HCO3-,故C错误;
D.甘氨酸含有羧基,可与氢氧化钠发生中和反应,离子方程式为H2N-CH2COOH+OH-→H2N-CH2COO-+H2O,故D正确.
故选D.
点评 本题考查离子反应的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意单质、弱电解质、沉淀等在离子反应中保留化学式,注重基础知识的考查,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:解答题
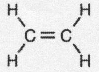 .
.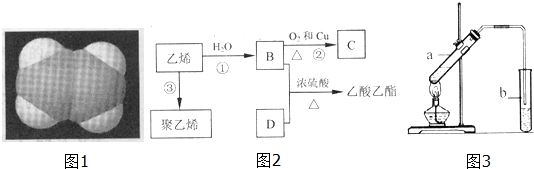
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
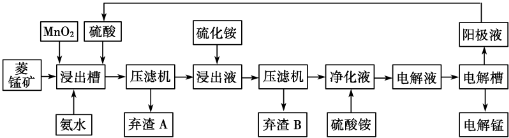
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
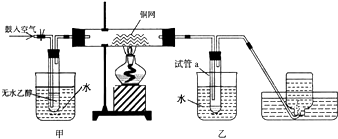
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,冷却水从冷凝管的上口通入,下口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制1.00 mol/L NaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉-碘化钾溶液和溴水 | B. | 氢氧化钠溶液与碘水 | ||
| C. | 新制Cu(OH)2悬浊液与碘水 | D. | 碘化钾溶液与碘水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com