
【题目】某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z,它们的物质的量随时间的变化如图所示,则下列说法正确的是(注:转化率=某反应物变化的浓度除它的起始浓度)

A. 反应的化学方程式是 X+2Y = 2Z
B. 该反应达到平衡时反应物 X 的转化率α等于 55%
C. 该反应在 0-3min 时间内产物 Z 的平均反应速率 0.083mol·L-1·min-1
D. 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】实验室常用的玻璃仪器①试管;②烧杯;③量筒;④普通漏斗;⑤分液漏斗;⑥烧瓶;⑦滴管;⑧容量瓶。其中把碘水中的碘提取出来用到的仪器有 ( )
A. ②④⑥B. ②⑤C. ③⑤⑥⑧D. ②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,不会出现丁达尔效应的分散系是( )
①鸡蛋白溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 ⑤Fe(OH)3胶体
A. ②④ B. ①③ C. ③⑤ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的同周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物对应水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号: A ___,B____,C____,D____,E________。
(2)写出A、B两元素最高价氧化物对应水化物相互反应的化学方程式:_____________________________。
(3)比较C、D的最高价氧化物对应水化物的酸性:_____________(用化学式表示) 。
(4)用离子方程式表示实验室制取E的单质的原理:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 molL-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 1 molL-1的NaCl B. 75 mL 2 molL-1的NH4Cl
C. 150 mL 3 molL-1的KCl D. 75 mL 2 molL-1的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用如图装置进行某些气体的制备和性质实验,图中加持装置有省略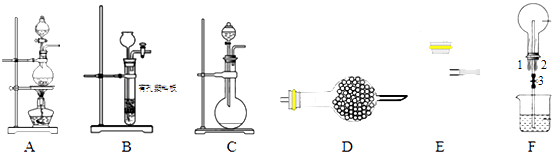
(1)为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气和氨气反应,实验室打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 .
(4)利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 . 若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是 .
(5)将装置B、C分别于F相连后,进行硫化氢和二氧化硫反应的实验,烧杯中的试剂所起的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( ) 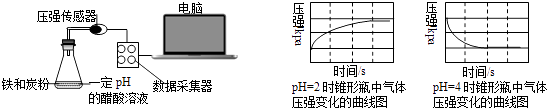
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为 , 若只改变一个影响因素,当平衡移动时,K值变化(填“一定”或“不一定”);当K值变大时,逆反应速率 . (填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是 . a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为 .
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是 .
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是 , 请结合离子方程式,运用平衡原理进行解释: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com