

| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| 1.0 |
| 1.0 |
| c(CO) |
| c(CO2) |
 ,
, .
.


科目:高中化学 来源: 题型:
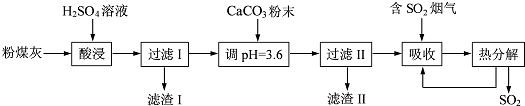
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向溴乙烷中加入NaOH溶液,加热,充分反应后,加入AgNO3溶液 | 观察生成沉淀的颜色,以确定含有溴元素 |
| B | 向乙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定乙醛中是否含有醛基 |
| C | 向苯和酒精的混合液中加入金属钠 | 确定苯中是否有酒精 |
| D | 纯净的乙炔气通入溴水溶液中,溴水褪色,且溶液pH前后变化不大 | 说明乙炔与Br2发生了加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
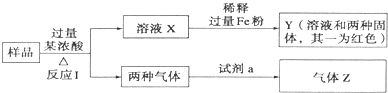
| A、一定含CuO和C |
| B、一定含Fe2O3、CuO和C |
| C、一定含CuO和C,一定不含Al |
| D、不管试剂a为H2O或饱和NaHCO3溶液,气体Z都为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤②⑥④③ |
| B、①⑤②④⑥③ |
| C、①②④⑥⑤③ |
| D、①②⑤⑥④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价键都是极性的 |
| B、共价键的键能越大,共价键越牢固,含有该键的双原子分子越稳定 |
| C、CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等 |
| D、H2O分子中2个O-H键夹角为180° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com