
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H﹣)亦增大
C.溶液中 不变
D.溶液中 ![]() 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2 mL棍合,所得溶液的pH为1,则V1:V2=(溶液体积变化忽略不询.
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为O.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 .
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+H2O+CO2
【答案】
(1)c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
(2)C,D
(3)1:1;AD
(4)A;AB
【解析】解答:解:(1)n(NaOH)=3mol/L×0.1L=0.3mol,n(CO2)= ![]() =0.2mol,设生成的碳酸钠的物质的量为x、碳酸氢钠的物质的量为y,则
=0.2mol,设生成的碳酸钠的物质的量为x、碳酸氢钠的物质的量为y,则 ![]() ,解得
,解得 ![]() ,即碳酸钠和碳酸氢钠的物质的量都是0.1mol,碳酸钠和碳酸氢钠混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,再结合物料守恒判得该混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),
,即碳酸钠和碳酸氢钠的物质的量都是0.1mol,碳酸钠和碳酸氢钠混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,再结合物料守恒判得该混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),
所以答案为:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+);(2)A.加水稀释促进醋酸电离,则溶液中导电粒子的数目增加,所以错误;
B.醋酸的电离程度增大,但溶液中c(H﹣)减小,所以错误;
C.溶液中 ![]() =
= ![]() ,温度不变,则电离平衡常数、水的离子积常数不变,所以溶液中
,温度不变,则电离平衡常数、水的离子积常数不变,所以溶液中 ![]() 不变,所以正确;
不变,所以正确;
D.溶液中水的电离程度增大,则 ![]() 减小,所以正确;
减小,所以正确;
所以选CD;(3)①溶液中氢氧化钠的物质的量为:V2×10﹣3L×0.1mol/L=V2×10﹣4mol,
稀硫酸的物质的量为:V1×10﹣3L×0.15mol/L×2=3V1×10﹣4mol,
两溶液混合后溶液显示酸性,氢离子浓度为1×10﹣1molL﹣1 ,
则有:3V1×10﹣4mol﹣V2×10﹣4mol=(V1+V2)×10﹣3L×1×10﹣1molL﹣1=(V1+V2)×10﹣4mol,
解得V1:V2=1:1,
所以答案为:1:1;
②A.若混合溶液呈中性,则溶液中c(H+)=c(OH﹣)=2×10﹣7 molL﹣1 , 所以溶液中c(H+)+c(OH﹣)=2×10﹣7 molL﹣1 , 所以正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,所以错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2 , 所以错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2 , 所以正确;所以选AD;(4)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大,根据钠盐溶液pH确定酸的强弱;相同浓度的不同酸,加水稀释促进弱酸电离,则稀释相同的倍数,酸的酸性越弱,酸溶液稀释过程中pH变化越小,根据钠盐溶液的pH知,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最小的是HCN,所以选A;
②HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,根据强酸制取弱酸知,
A.酸性CH3COOH>H2CO3>HCO3﹣ , 所以二者反应为CH3COOH+Na2CO3═NaHCO3+CH3COONa,所以正确;
B.醋酸酸性大于HCN,所以二者反应为CH3COOH+NaCN═CH3COONa+HCN,所以正确;
C.碳酸酸性大于次氯酸,所以二者反应为CO2+H2O+NaClO═NaHCO3+NaClO,所以错误;
D.酸性H2CO3>HClO>HCN,所以NaHCO3、HCN二者不反应,所以错误;
所以选AB;
分析:本题考查较综合,涉及离子浓度大小比较、弱电解质的电离、难溶物的溶解平衡等知识点,根据溶液中的溶质及其性质确定溶液中离子浓度大小,知道酸的强弱与酸根离子水解程度的关系,知道弱电解质稀释过程中各种离子浓度变化.


科目:高中化学 来源: 题型:
【题目】将铁与氧化铁的混合物15克,加入150mL稀硫酸中,标况下放出氢气1.68升,同时铁和氧化铁均无剩余,向溶液中滴加KSCN溶液,未见颜色变化.
(1)混合物中铁的质量为g.
(2)为使Fe2+完全转化为Fe(OH)2 , 共消耗3molL﹣1的氢氧化钠溶液200mL,则原硫酸的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl36H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl36H2O晶体. 填写下列空白:
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 .
(2)烧杯内放过量稀HNO3的原因是(用离子方程式表示).
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是 .
(4)乙同学对该实验进行了改进,他是用空烧杯盛接滤液,加入适当的试剂,然后在HC1的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl36H2O,你认为加入的试剂可以是 . (填序号) ①适量氯气 ②适量过氧化氢和稀盐酸
③酸性高锰酸钾溶液 ④氢氧化钠溶液.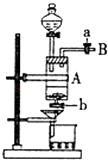
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应过程不符合下图关系的是( )
A.向一定量铜片中加入过量浓硝酸
B.向一定量AlCl3溶液通入过量NH3
C.向一定量澄清石灰水中通入过量CO2
D.向一定量MgCl2溶液中滴加过量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第二次世界大战中,抗生素( )拯救了成千上万士兵的生命,当时被誉为与原子弹、雷达齐名的三大发明之一.
A.青霉素
B.阿司匹林
C.红霉素
D.吗啡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是( )
A.10:1
B.1:10
C.9:1
D.1:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com