
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
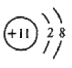
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)
【答案】![]()
 NH4+、H3O+ 氟 略
NH4+、H3O+ 氟 略 ![]() 18 HNO3 NH4NO3
18 HNO3 NH4NO3
【解析】
A最外层的电子数是次外层电子数的3倍,则A为O元素;海水中含量第一位的金属元素是钠,则B为Na元素;L层得1个电子后成为稳定结构,说明该原子最外层有7个电子,C为F元素;二价阴离子核外有18个电子,则D原子核内有16个质子,D为S元素;E失去一个电子后就成为一个质子,则E为H元素;F的单质为大气中含量最多的气体,则F为N元素。
(1)A为O元素,原子的电子式:![]() ,
,
答案为:![]() 。
。
(2)B为Na元素,钠离子的结构示意图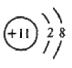 ,与钠离子质子数与电子数均相同的微粒可能是NH4+、H3O+,
,与钠离子质子数与电子数均相同的微粒可能是NH4+、H3O+,
答案为: ;NH4+、H3O+。
;NH4+、H3O+。
(3)C为F元素,名称为氟,氟原子有两个电子层,能量最高的电子位于第L层。
答案为:L。
(4)D为S元素,S的二价阴离子是S2-,电子式为![]() ;S元素的某种同位素原子质量数为34,S的质子数为16,则原子核内的中子数为34-16=18。
;S元素的某种同位素原子质量数为34,S的质子数为16,则原子核内的中子数为34-16=18。
答案为:.![]() ;18。
;18。
(5)A、E、F三种元素分别为O、H、N,能相互形成多种类别的物质,其中属于共价化合物为HNO3,离子化合物为NH4NO3;
答案为:HNO3 ;NH4NO3。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJmol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
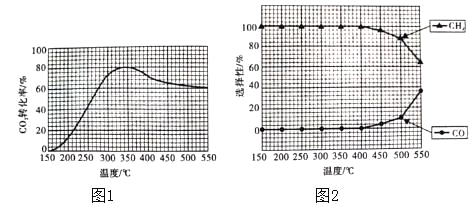
①下列说法不正确的是_____(填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____(用a、V表示)。
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____

(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是

A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙溶于酸,极微溶于水,不溶于乙醇、乙醚和丙酮,通常可用作医用杀菌剂、消毒剂、防腐剂。已知从溶液中制得的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在350℃时会迅速分解生成CaO和O2.以下是一种用纯净的碳酸钙制备过氧化钙的实验方案。请回答下列问题:
CaCO3![]() 滤液
滤液![]()
![]() 白色结晶
白色结晶
(1)步骤①的具体操作为向碳酸钙中逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈_____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是_____。
(2)步骤②中反应的化学方程式为_____,该反应需要在冰浴下进行,原因是_____。
(3)过滤得到的白色晶体先用蒸馏水洗涤,再用乙醇洗涤,使用乙醇洗涤的目的是_____。
(4)过氧化钙在水产养殖方面可以作为释氧剂,也可以作为观赏鱼苗空运的水中添加剂,用化学方程式表示其作用原理_____。
(5)为测定产品中过氧化钙的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过图所示装置收集,测得量筒中水的体积为VmL,则产品中过氧化钙的质量分数为_____(列出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
A. ① > ② > ③ B. ③ > ① > ②
C. ③ > ② > ① D. ② > ① > ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com