
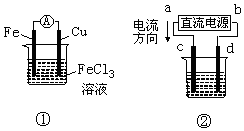
| A. | 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 装置①中,铁做负极,该电极反应式为:Fe3++e-═Fe2+ | |
| C. | 装置②为铁上镀铜装置c为纯铜电极 | |
| D. | 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
分析 A.Fe比Cu的还原性强,Fe为负极;
B.Fe失去电子生成亚铁离子;
C.由电流从正极到负极可知,a为正极,c为阳极,铁上镀铜时Cu为阳极;
D.用装置②精炼铜,a为正极,粗铜作阳极.
解答 解:A.Fe比Cu的还原性强,Fe为负极,则装置①是原电池,总反应是Fe+2Fe3+═3Fe2+,故A错误;
B.Fe失去电子生成亚铁离子,则装置①中,铁做负极,该电极反应式为:Fe-2e-═Fe2+,故B错误;
C.由电流从正极到负极可知,a为正极,c为阳极,铁上镀铜时Cu为阳极,则c为纯铜电极,故C正确;
D.用装置②精炼铜,a为正极,粗铜作阳极,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液,故D错误;
故选C.
点评 本题考查原电池及电解池,为高频考点,把握装置、电极反应为解答的关键,侧重分析与应用能力的考查,注意电化学原理的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol•L-1 | B. | 0.10 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.40 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电解后电池中c(KOH)不变;c(Na2CO3)不变 | |
| D. | 电解后电解池中溶液pH变大,且溶液中有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5 mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 标况下,22.4 L四氯化碳的质量为154 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释 | |
| B. | 用铁质自来水管与铜质水龙头连接使用时,连接处的铁水管锈蚀更快 | |
| C. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| D. | 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:3:1 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 将氯气通入紫色石蕊试液,先变红,后褪色 | |
| C. | 次氯酸不稳定,见光易分解 | |
| D. | SO2使紫色酸性高锰酸钾溶液褪色,体现了SO2强还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com