
(每小题4分,共12分)
(1)氨水和稀盐酸反应后的溶液呈中性,反应后所得溶液中的离子浓度大小关系是__ _。
(2)Na2CO3溶液中,其离子浓度从大到小关系为 。
(3)有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.则原混合溶液中Ba(OH)2的物质的量浓度 。
(1) c(NH4+)=c(Cl-) >c(OH-)=c(H+) ;(2) C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
(3)0.025mol/L
【解析】
试题分析:(1)氨水和稀盐酸溶液呈中性,c(OH-)=c(H+) 溶液中含有铵根离子、氯离子、氢氧根离子和氢离子,故离子浓度为c(NH4+)=c(Cl-) >c(OH-)=c(H+);(2)碳酸钠为强碱弱酸盐,水解呈碱性,以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);(3)发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O、2NaOH+H2SO4=Na2SO4+2H2O,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半,说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的,所以Ba(OH)2、NaOH的物质的量浓度比为1:2,因为pH=13,所以原溶液中2c[Ba(OH)2]+c(NaOH)=0.1mol/L,故2c[Ba(OH)2]+2c[Ba(OH)2]=0.1mol/L,解得c[Ba(OH)2]=0.025mol/L,答案为0.025mol/L
考点:化学方程式的有关计算


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是 ( )

A.反应开始到10s,用Z表示的反应速率0.158mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:填空题
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ___ ___。
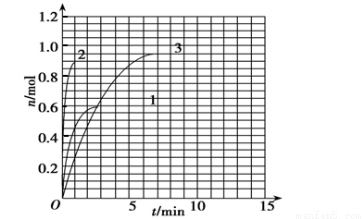
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:?(正) ?(逆)(填 < > =)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列图象正确的是( )
2C(g) △H<0,下列图象正确的是( )

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280 kJ,断裂1molF-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:选择题
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是
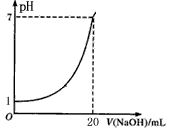
A.标准液盐酸的浓度为0.1 mol/L
B.NaOH溶液的浓度为0.05 mol/L
C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D.指示剂变色时,说明盐酸与NaOH恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:选择题
一只50mL酸式滴定管盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL B.为40.0 mL
C.大于10.0 mL D.为10.0mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
(2)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(3)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(反应方程式为:2Na2S+Na2CO3+ 4SO2===3Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。
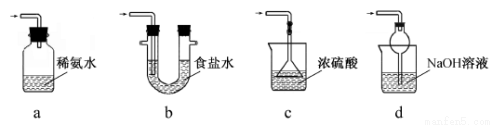
Ⅱ.【制备产品】实验装置如图所示:

请回答下列问题:
(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式______________________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____________________(填写操作名称)、过滤、洗涤、干燥、得到产品。
(2) 装置A用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____________________。
III.【测定产品纯度】
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O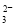 +I2===S4O
+I2===S4O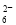 +2I-(忽略Na2SO3与I2反应)
+2I-(忽略Na2SO3与I2反应)
(4)滴定至终点时,溶液颜色的变化:_________________________________。
(5)滴定起始和终点的液面位置如图,则产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
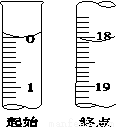
IV.【探究与反思】
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_______________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7g氯化钠晶体 ④用碱式滴定管取23.10 mL溴水 ⑤用瓷坩埚灼烧各种钠化合物 ⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④ B.③⑥ C.②③④⑥ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com