
| A. | C3H7Cl | B. | C3H8 | C. | C4H10 | D. | C2H6O |
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是 ( )
A.11.2 g B.25.2 g C.16.8 g D.33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
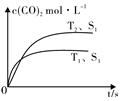 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI组成的平衡体系加压后颜色变深 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 使用催化剂可加快SO2转化为SO3的速率 | |
| D. | 将木炭粉碎后与O2反应,速率更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
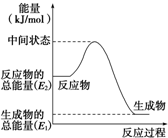 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经电解液流向正极 | |
| D. | 该电池放电时,负极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com