
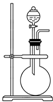
 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为
(1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为查看答案和解析>>
科目:高中化学 来源: 题型:
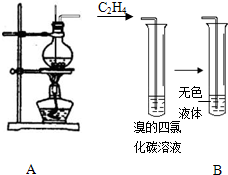 某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.
某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| Y | Z | W |
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:X>Z |
| C、W的最高价氧化物与水反应形成的化合物是离子化合物 |
| D、X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com