
分析 Y原子的L层p轨道中有2个电子,其核外电子排布式为1s22s22p2,则Y为碳元素;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,含有d轨道处于第四周期,最外层电子数为2,d轨道电子数为10,则其核外电子排布式为1s22s22p63s23p63d104s2,故W为锌元素;Z与Y原子的价电子数相同,最外层为四个电子且均位于元素周期表的前四周期,原子序数小于Zn,则Z为硅元素;四元素核电荷数之和为51,故X原子核电荷数=51-30-6-14=1,则X为氢元素,据此解答.
解答 解:Y原子的L层p轨道中有2个电子,其核外电子排布式为1s22s22p2,则Y为碳元素;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,含有d轨道处于第四周期,最外层电子数为2,d轨道电子数为10,则其核外电子排布式为1s22s22p63s23p63d104s2,故W为锌元素;Z与Y原子的价电子数相同,最外层为四个电子且均位于元素周期表的前四周期,原子序数小于Zn,则Z为硅元素;四元素核电荷数之和为51,故X原子核电荷数=51-30-6-14=1,则X为氢元素.
(1)C与Si可分别与H形成只含一个中心原子的共价化合物CH4、SiH4,所以a是CH4,b为SiH4,甲烷、硅烷分子中C、Si原子都形成4个σ键不含孤电子对,所以C、Si原子都是采取sp3杂化,甲烷分子是正四面体构型,故答案为:CH4;SiH4;sp3;sp3;正四面体;
(2)Y元素最高价氧化物为二氧化碳,Z的最高价氧化物是二氧化硅,二氧化碳是分子晶体,二氧化硅是原子晶体,故答案为:分子;原子;
(3)X的氧化物是水,Y的氧化物是二氧化碳,水是极性分子,二氧化碳是非极性分子,所以分子极性较小的是CO2,故答案为:CO2;
(4)碳和硅是同一主族元素,同一主族元素中元素的电负性随着原子序数的增大而减小,所以电负性较大的是C,故答案为:C;
(5)W是Zn元素,锌原子失去最外层2个电子变成+2价阳离子,其核外电子排布式为1s22s22p63s23p63d10,故答案为:Zn;1s22s22p63s23p63d10.
点评 本题考查结构性质位置关系应用、核外电子排布规律、杂化理论,分子结构与晶体类型、电负性等知识点,正确推断元素是解本题的关键,注意基态原子最外层电子能量不一定最大,但失电子时首先失去最外层电子,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 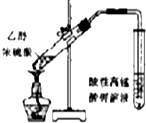 如图装置检验加热时产生的乙烯 | |
| B. | 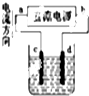 如图装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液. | |
| C. | 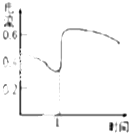 如图表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 | |
| D. | 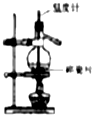 如图装置分离溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
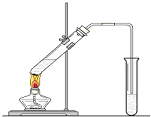 如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.
如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com