
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。

(1)D装置中MnO2的作用是_________________。
(2)燃烧管中CuO的作用是_____________________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为__________________。
(4)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为___。
(5)该物质的核磁共振氢谱如图二所示,则其结构简式为_____________。
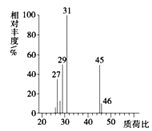
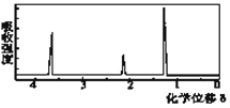
图2 图3
【答案】 作催化剂、加快O2的速率 使有机物更充分氧化为CO2、H2O C2H6O 46 CH3CH2OH
【解析】D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则
(1)MnO2为双氧水分解制备氧气的催化剂,可加快反应速率;(2)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;(3)A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×12/44×100%=0.48g,B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×2/18×100%=0.12g,从而可推出含氧元素的质量为:0.92g-0.48g-0.12g=0.32g,设实验式为CxHyOz,则x:y:z=0.48/12:0.12/1:0.32/16=2:6:1,则其实验式为:C2H6O;(4)质谱图可知有机物的相对分子质量为46;(5)有机物的实验式为:C2H6O,设分子式为(C2H6O)n,相对分子质量为46n,而有机物的相对分子质量为46,则n=1,所以分子式为C2H6O;(6)核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,所以其结构简式为:CH3CH2OH。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,过滤所得滤液中滴加NaHSO4溶液,则发生的离子反应为:H++OH-=H2O
C. c点,两溶液中离子总浓度相同
D. a点对应的溶液显中性,d点对应的溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于泡合物的分离和提纯装置,请根据装置回答问题:
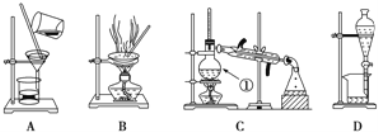
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_____,装置B中玻璃棒的作用是_________。
(2)装置C中①的名称是_____,此装置中冷凝水进出方向是_____。装置D中的分液漏斗在使用之前应该_____,在分液时为使液体顺利滴下,应进行的具体操作是_______。
(3)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的方法是______。加入Na2CO3溶液的目的是_____,所加入的试剂④可以是_____(填化学式)。
(4)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
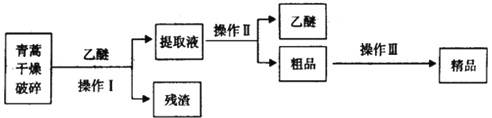
若要在实验室模拟上述工艺,操作I选择的装置是_____(填代号),操作Ⅱ的名称是_____,选择的装置是_____(填代号),为防止暴沸,粗品中需要加入_____。操作Ⅲ的主要过程可能是_____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶、过滤
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应 A+3B2C+D 在某段时间内以A的浓度变化表示的化学反应速率为0.5mol/(Ls)则此段时间内以B浓度变化表示的化学反应速率( )
A.0.5 mol/(Ls)
B.1.5 mol/(Ls)
C.2 mol/(Ls)
D.3 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
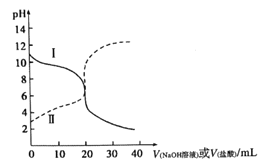
A. HX为强酸,ROH为弱碱
B. 滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C. 曲线Ⅱ:滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D. 滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为探究镁及其化合物的性质,查阅资料知:
ⅰ | Mg3N2遇水发生水解反应 |
ⅱ | 2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O |
ⅲ | 常溫下,NH3·H2O、CH3COOH的电离常数均为1.8×10-5 |
I.探究镁的性质。
为探究镁与二氧化氮反应的产物,设计如图所示实验装置。
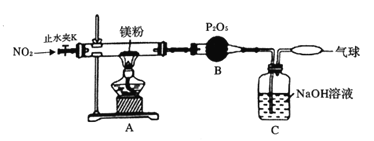
(1)简述检查该装置气密性的方法________;B装置的作用是___________.
(2)实验时,当A装置中充满红棕色气体时点燃酒精灯,这样操作的目的是_______。
(3)确定有N2生成的实验现象是__________。
(4)实验完毕,为确认产物中有Mg3N2,取少量A中固体于试管中,滴加蒸馏水,_______,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
请写出A中发生反应的化学方程式:___________________
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末于试管中,向其中加人足量饱和氯化氨溶液,振荡,白色粉末全部溶解。为了探究其原因,他们依据Mg(OH)2(s)==Mg2+(aq)+2OH-(aq)提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验验证哪一种假设正确:____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像描述正确的是( )
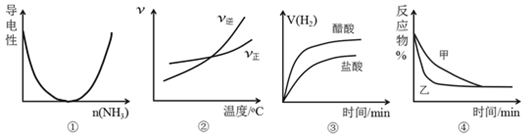
A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的镁粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④表示压强对可逆反应A(g)+B(g)![]() 2C(g)+D(g)的影响,乙的压强大
2C(g)+D(g)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO3·10H2O)配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要______________,应称取Na2CO3·10H2O晶体的质量为________克。
(2)下列操作中,容量瓶所不具备的功能有________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解 ②计算 ③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是:_____________________。(填序号)
(4)根据下列操作对所配溶液浓度偏高的有(填序号)____________。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④定容时俯视
⑤容量瓶未经干燥就使用 ⑥定容摇匀后,发现]液面低于刻度线,再加水到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC将117号元素命名为Ts(中文名“石田”,tián),Ts的原子核外最外层电子数是7。下列说法错误的是
A. Ts与F同主族 B. Ts的最外层p轨道中有5个电子
C. 在同族元素中Ts金属性最强 D. 中子数为176的Ts符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com