
【题目】A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
阴离子 | Cl-、CO32-、SO42-、NO3-、OH- |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
【答案】 氢氧化钡 氯化铝 CO32-+H2O![]() HCO3-+OH- > 酸性 Fe2(SO4)3 A12O3
HCO3-+OH- > 酸性 Fe2(SO4)3 A12O3
【解析】由己知离子组成的易溶于水的化合物中,显碱性的有NaCO3、Ba(OH)2、NaOH,其中0.1 mol/L,Ba(OH)2溶液的pH>13,又由于各化合物中离子组成不重复,故实验①可以确定B为Ba(OH)2,C为Na2CO3;由银氨溶液的制备可知实验④中的A为AgNO3;结合以上分析及实验②可知D为FeCl3或Fe2(SO4)3;再由实验③可知E为氯化物,故D只能是Fe2(SO4)3,则E为AlCl3。(1)B为氢氧化钡;E为氯化铝;(2)碳酸钠溶液显碱性是CO水解的缘故;0.1 mol/L的碳酸钠溶液中阴离子总数比0.1 mol/L的碳酸氢钠溶液中阴离子总数大;(3)D为Fe2(SO4)3,Fe3+水解显酸性;加热硫酸铁溶液促进Fe3+的水解,但硫酸为高沸点物质,不能挥发,加热蒸干得到的还是硫酸铁固体。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A. 用图1所示装置除去Cl2中含有的少量HC1
B. 用图2所示装置蒸干NH4C1饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后己分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1、闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙红色 |
③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
根据上述实验现象,判断以下结论中正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑤⑦
C. 可能含有的离子是①②⑥ D. 不能确定的离子是①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某气体能使品红溶液褪色,则该气体是SO2
B. 等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:
途径a: ![]()
C. 向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有SO![]()
D. 向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝。

根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象____________。
(2)U形管中溶液的颜色____________,说明有______生成。
(3)铜丝的变化现象______,说明有_____生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
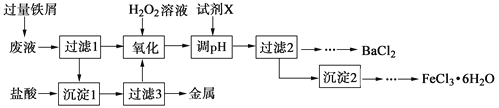
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y,可组成化合物XY3。当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是( )
A. ①② B. ①②③ C. ①②③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2

硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________、__________.
CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_________________.
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

在阳极区发生的反应包括___________和H++HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理___________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+![]() O2(g)═H2O(g)△H1=-242kJ/mol
O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com