
| A、标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA |
| B、3.6 g重水中含有的中子数为2NA |
| C、一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA |
| D、常温下,1 L 1 mol?L-1的CH3COOH溶液中,所含溶质分子数小于NA |
| 1.8g |
| 20g/mol |
| 6.4g |
| 64g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、pH=12的溶液:K+、Na+、CH3COO-、CO32- |
| B、0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl-、SO42- |
| C、与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3-、NO3- |
| D、由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、1000mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
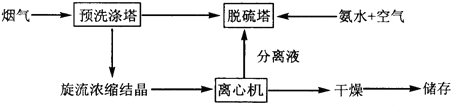
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=2的HCl与pH=12的NH3?H2O 等体积混合后溶液呈酸性 |
| B、常温下,用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va,Vb,则Vb<10Va |
| C、常温下,向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2 |
| D、常温下,pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
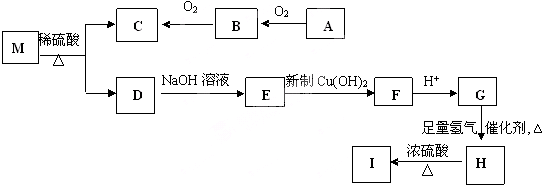
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全分解; S2Cl2+Cl2
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com