
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
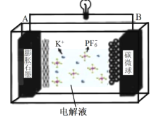
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
【答案】A
【解析】
放电时,B为碳微球(C)是正极,电极反应方程式为xC(PF6)+xe-=xC+xPF6-,A为膨胀石墨(C*y)是负极,负极电极反应方程式为KxC*y -xe-═C*y+xK+;充电时B为碳微球(C)是阳极,A为膨胀石墨(C*y)是阴极。
A.放电时为原电池反应,K+在电解质中由A极向B极迁移,但并未嵌入碳微球中,而是留在溶液中,故A错误;
B.充电时为电解池,A极为电解池的阴极,反应的电极反应式为C*y+xK++xe-═KxC*y,故B正确;
C.放电时,每转移0.1NA电子时,物质的量为0.1mol,电解质增重为0.1molKPF6,质量=0.1mol×184g/mol=18.4g,故C正确;
D.充放电过程中,阴离子移向阳极,PF6-在碳微球电极上可逆地嵌入/脱嵌,故D正确;
故选:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
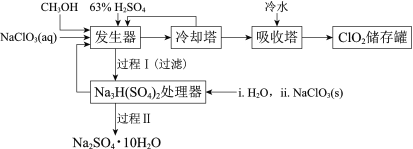
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
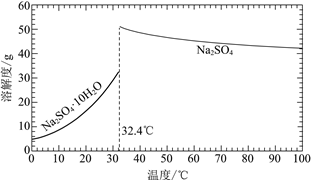
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是元素周期表的一部分,回答下列有关问题:
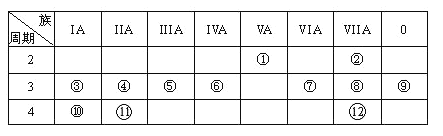
(1)写出元素⑥的元素符号:__________,元素⑦离子的电子式__________。
(2)画出元素④的原子结构示意图:________________________。
(3)在这些元素中,最不活泼的元素是__________(写元素符号)。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________,碱性最强的是_____________,呈两性的氢氧化物是_______________。(以上均要求写化学式)
(5)推测50号元素在周期表中的位置:_________________________________。
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,试写出一条第三周期元素所形成的化合物某种性质的变化规律:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某矿渣(成分为NiFe2O4、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
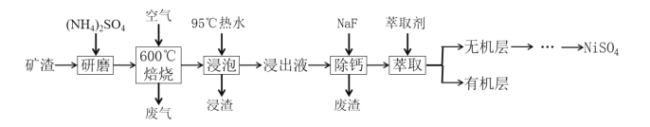
已知①600℃时发生反应:NiFe2O4+4H2SO4═NiSO4+Fe2(SO4)3+4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将NiFe2O4写成氧化物的形式为__;(NH4)2SO4的作用是__。
(2)“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为__。
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有__(写化学式)。
(4)向“浸出液”中加入NaF以除去Ca2+,当溶液中c(F-)=2.0×10-3molL-1时,若除钙率为99%,则原“浸出液”中c(Ca2+)=__gL-1。
(5)“萃取”后,分离得到无机层的操作为__,用到的主要玻璃仪器是__。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4是倍受关注的一类新型、高效、无毒的多功能水处理剂。回答下列问题:
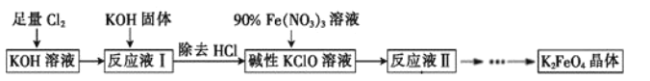
①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为__。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn在周期表中__区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式_。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因是__。
②溶液中的水存在H3O+、H5O2+等微粒形式,H5O2+可看作是H3O+与H2O通过氢键形成的离子,则H5O2+的结构式是__。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
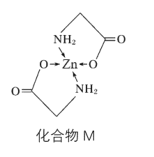
①1molM含有的σ键的数目为__。
②常见含N的配体有H2NCH2COO-、NH3、N3-等,NH3的分子空间构型为__,N3-的中心N原子杂化方式为__。
③M在人体内吸收率高的原因可能是锌形成螯合物后,电荷__(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ZnX2 | ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
熔点/℃ | 872 | 283 | 394 | 445 |
则ZnX2熔点如表变化的原因是__。
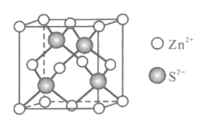
(5)Zn的某种硫化物的晶胞如图所示。已知晶体密度为dgcm-3,且S2-、Zn2+相切,则Zn2+与S2+的核间距为__nm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期表分析下列判断,其中错误的是( )
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢(![]() )是有色、有毒的气体,比
)是有色、有毒的气体,比![]() 稳定
稳定
C.![]() 的酸性比
的酸性比![]() 的酸性弱
的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物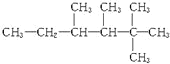 用系统命名法命名_________
用系统命名法命名_________
(2)若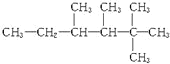 是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___;其中未成对电子数为___。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___。1mol[Cu(H2O)4]2+中含有σ键的个数为___(NA表示阿伏加德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___,所含元素的电负性大小顺序为___。
(4)金属铜的晶胞结构如图所示。
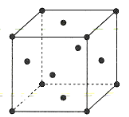
①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___pm(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com