
能实现下列物质间直接转化的元素是( )
单质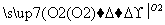 氧化物
氧化物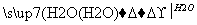 酸或碱
酸或碱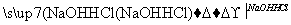 盐
盐
A.硅 B.硫
C.铜 D.铁
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①H3PO2中,磷元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐?
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:2NO+O2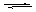 2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
(1)30 s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
________,图像中曲线________(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(3)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
(4)上述800 ℃时的反应达到平衡时测得放出热量a kJ。试写出在此条件下NO与氧气反应的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________(填字母)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)画出N的原子结构示意图:________。根据元素周期律知识,请写出氮化硅的化学式:________________________________________________________________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________(填字母)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)画出N的原子结构示意图:________。根据元素周期律知识,请写出氮化硅的化学式:________________________________________________________________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量相同的四份Cu粉,分别置于过量的下列酸里,产生气体的物质的量最多的是( )
A.稀H2SO4 B.浓H2SO4
C.稀HNO3 D.浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列转化关系中,B、D都是淡黄色固体,且D和A都是单质。
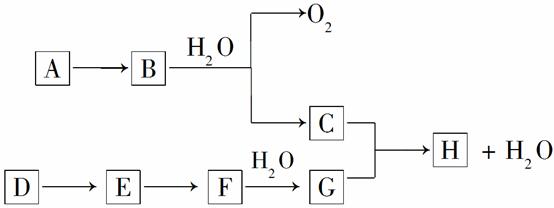
(1)写出下列物质的化学式:A__________,G__________,H__________。
(2)写出E→F,F→G的化学方程式:
E→F________________________________________________________________________;
F→G________________________________________________________________________。
(3)写出E和足量的C溶液反应的离子方程式____________________。
(4)0.5千克含D 48%的某物质能转化为含G 98%的溶液多少千克(所含的D有98%转化为G)?
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑可用于地下水脱氮,实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 .
(2)烘干时需要在N2保护下进行的原因是 .
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 .
(4)将酸性条件下,铁与NO3﹣反应的离子方程式补充完整:
Fe+ NO3﹣+ + ═ Fe2++ NH4++ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com