

科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳通过灼热的氧化铁 | B. | 氧化铝溶于盐酸 | ||
| C. | 过氧化钠固体中通人水蒸气 | D. | 氢氧化亚铁露置在空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | A | B | C | D | E |
| 硝酸溶液体积 | 100ml | 200mL | 300mL | 400mL | 500mL |
| 剩余固体的质量 | 17.2g | 8g | 0g | 0g | 0g |
| 气体体积 | 2.24L | 4.48L | 6.72L | 7.84L | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
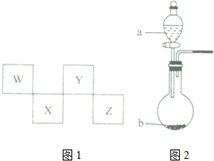 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物. ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com