
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是( )
A.N点时溶液中的溶质只有NaCl
B.原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C.c (NaOH)=c (HCl)
D.M点之前加入的是NaOH溶液,M点之后加入的是盐酸

B
【解析】本题考查镁、铝及其化合物的知识,N点的沉淀量最大,发生的反应有:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=A1(OH)3↓,Mg2+和Al3+完全沉淀,溶液中只有NaCl;从N点到M点可知,Al(OH)3的溶解需要1 mL的NaOH溶液,而Mg2+和A13+的沉淀需要5 mL的NaOH溶液,根据关系:Mg2+~2OH-,Al3+~3OH-,可知c (MgCl2)∶c (AlCl3)=1∶1;根据反应过程:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓,A1(OH)3+3H+=A13++3H2O,Mg(OH)2+2H+=Mg2++2H2O,所以消耗NaOH和盐酸的物质的量相同,又因为两者消耗的体积相同,所以c (NaOH)=c (HCl);M点沉淀的量最小,说明A1(OH)3全部溶解,M点之后沉淀量又增加,知其加的是盐酸。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。

请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
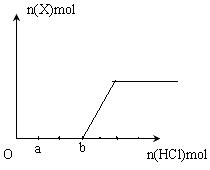
请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是
A.HNO3是氧化剂,NO2是氧化产物
B.若2mol HNO3(浓)完全反应,则反应中共转移了NA个电子
C.还原剂与氧化剂的物质的量比是1 :4
D.氧化产物和还原产物的物质的量之比为2 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.所有的不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞出的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读材料,回答下列问题。
近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融或固体粉末的铝合金中而制成的,其优点是硬度高,密度小(约为0.16 g/cm3~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年就可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是( )。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔做食品包装,是利用它的( )。
A.金属光泽 B.延展性 C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:
与盐酸反应的离子方程式:________。
与氢氧化钠溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液能与铝反应生成氢气,则溶液中可能大量共存的离子组为( )
A.H+、Ba2+、Mg2+、NO3- B.Cl-、Cu2+、Mg2+、SO42-
C.OH-、NO3-、Ba2+、Cl- D.H+、Fe3+、Cl-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
A~J分别表示中学化学中常见的物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出)。已知:G为金属元素的固态氧化物(常温下);A、B、C、D、E、F六种物质中均含有同一种元素。(已知F为红褐色沉淀)

请填写下列空白:
(1)物质G的化学式是________。
(2)写出反应⑤的化学方程式________,写出反应④的离子方程式________。
(3)反应①~⑥中,不属于氧化还原反应的是________。(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) ▲0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= ▲ mol·L-1,c (H+) − c (MOH) = ▲ mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 ▲ (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 ▲ 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH ▲ 7(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)  2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________ _______。
(3)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为____ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com