
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
分析 由元素在周期表的位置可知,A~H元素分别为H、Na、Al、N、P、F、Cl、Ne,
(1)F的非金属性最强,Na的金属性最强,Ne的最外层为8电子稳定结构;
(2)非金属性越强,氢化物越稳定;
(3)金属性越强,最高价氧化物水化物碱性越强,非金属性越强,最高价氧化物水化物酸性越强;
(4)E为P,核外电子数为15.
解答 解:由元素在周期表的位置可知,A~H元素分别为H、Na、Al、N、P、F、Cl、Ne,
(1)F的非金属性最强,Na的金属性最强,Ne的最外层为8电子稳定结构,则氧化性最强的单质是F2,还原性最强的单质是Na,化学性质最不活泼的单质是Ne,
故答案为:F2;Na;Ne;
(2)F的非金属性最强,氢化物HF最稳定,故答案为:HF;
(3)金属性越强,最高价氧化物水化物碱性越强,非金属性越强,最高价氧化物水化物酸性越强,则B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOH、Al(OH)3、H3PO4、HClO4,故答案为:NaOH、Al(OH)3、H3PO4、HClO4;
(4)E为P,核外电子数为15,核外电子总共有15种运动状态,故答案为:15.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题




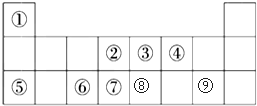
| A. | ⑧ | B. | 除⑥⑦外 | C. | 除③⑥⑦⑨外 | D. | ①④⑧⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素 | |
| C. | 人体需要的二十多种氨基酸,都可以通过人体自身合成 | |
| D. | 在一定条件下,它们都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| A | 基态原子2p能级有3个单电子 |
| B | 基态原子p轨道上成对电子数等于未成对电子数 |
| C | 氢化物常用于刻蚀玻璃 |
| D | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| E | 原子序数等于C与D的原子序数之和 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
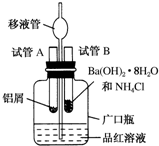 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互溶的液态混合物可用分液的方法分离 | |
| B. | 互不相溶的液态混合物可用分液的方法分离 | |
| C. | 沸点不同的液态混合物可用蒸馏的方法分离 | |
| D. | 氯化钠和氧化铜形成的混合物可以按溶解、过滤、蒸发的顺序分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com