
| A. | 过氧化钠、二氧化硫属于氧化物,而次氯酸属于弱酸,臭氧属于单质 | |
| B. | 它们都能使品红溶液褪色,但褪色原理不同;加热褪色的溶液都能变红 | |
| C. | 二氧化硫能与其他三种物质发生氧化还原反应,二氧化硫表现还原性 | |
| D. | 过氧化钠溶于水产生的气体与臭氧互为同素异形体,臭氧比氧气活泼 |
分析 A、过氧化钠、二氧化硫中只含两种元素所以是氧化物,而次氯酸属于一元弱酸,臭氧属于单质;
B、过氧化钠、次氯酸和O3的漂白是氧化还原漂白不可逆;
C、二氧化硫与Na2O2、HClO、O3发生氧化还原反应,硫元素的化合价升高;
D、过氧化钠溶于水产生的气体是氧气,氧气与臭氧互为同素异形体,其中臭氧比氧气活泼.
解答 解:A、过氧化钠、二氧化硫中只含两种元素所以是氧化物,而次氯酸属于一元弱酸,臭氧只有一种元形成的纯净物属于单质,故A正确;
B、过氧化钠、次氯酸和O3的漂白是氧化还原漂白不可逆,所以过氧化钠、次氯酸和O3的漂白不可逆,故B错误;
C、二氧化硫与Na2O2、HClO、O3发生氧化还原反应,硫元素的化合价升高,所以反应中二氧化硫是还原剂,表现还原性,故C正确;
D、过氧化钠溶于水产生的气体是氧气,氧气与臭氧互为同素异形体,其中臭氧比氧气活泼,故D正确;
故选B.
点评 本题考查过Na2O2、HClO、SO2、O3的性质、漂白原理等,难度不大,掌握常见具有漂白性物质的漂白原理.


科目:高中化学 来源: 题型:选择题
| A. | N a、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水产生具有吸附性的胶体粒子,可作漂白剂 | |
| B. | 植物油分子中有碳碳双键,与H2加成后可以得到人造脂肪 | |
| C. | CO2、CH4、N2等均是造成温室效应的气体 | |
| D. | Fe在少量Cl2中燃烧生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙烯分子中含有共用电子对数为6NA | |
| B. | 常温常压下,32gO2、O3的混合物含有Na个氧原子 | |
| C. | 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA | |
| D. | 7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 荒野中出现的忽明忽暗的“天火” | |
| B. | 在低温、加压的条件下无色的气态氧变成淡蓝色的液体 | |
| C. | 固态物质在加热的条件下融化成为液体,在更高的温度下转变为气体 | |
| D. | 把棉布染上颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
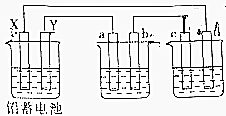 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )| A. | 电路中通过1mol电子时,Y电极质量增加48g | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO${\;}_{4}^{2-}$(aq)+2e-=PbSO4(s)+2H2O(l) | |
| C. | c、d电极产生气体的物质的量之比为1:2 | |
| D. | X极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
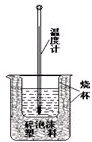 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

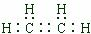 ;B中含官能团名称是羟基.
;B中含官能团名称是羟基.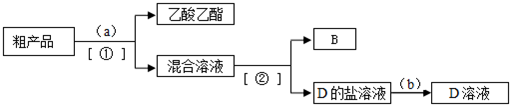
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com