
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2017届山东省济南市高三第一次模拟考试理科综合化学试卷(解析版) 题型:简答题
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。

① 反应2NO(g) N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:宁夏勤行校区2016-2017学年高二下学期第一次(3月)月考化学试卷 题型:选择题
下列离子的VSEPR模型与其立体构型一致的是( )
A. SO B. ClO
B. ClO C. NO
C. NO D. ClO
D. ClO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二3月月考化学试卷(解析版) 题型:简答题
(I)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理____________,哪些违反了洪特规则_______________。哪些既没有违反泡利原理又没有违反洪特规则_______________。

(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:______和______;______和______.
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______、______.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二3月月考化学试卷(解析版) 题型:选择题
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2
A. ①② B. ②③ C. ③④ D. 全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二3月月考化学试卷(解析版) 题型:选择题
某化学学习小组在学习元素周期系和周期的划分时提出了以下观点:
①周期系的形成是由原子的结构决定的;
②元素周期系中IA族元素统称为碱金属元素;
③每一周期的元素原子外围电子排布均是从nsl开始至ns2np6结束;
④元素周期系的每一周期元素的种类均相等;
⑤基态原子电子排布为ls22s22p3和ls22s22p63s23p3的两元素原子位于同一周期;
⑥周期序号越大,该周期所含金属元素一般越多。
你认为正确的是
A. ①②③⑤⑥ B. ①⑥ C. ①④⑥ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆第二外国语学校高一下学期3月份月考化学试卷(解析版) 题型:简答题
根据下列几种粒子的结构示意图,回答问题:

(1)属于阴离子的是______(填粒子代号,下同)
(2)属于金属元素的是_______________________
(3)具有相似化学性质的是____________________
(4)D2C2含有的化学键类型有___________________(选填“离子键”“极性键”“非极性键”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南师范大学附属中学高一下学期第一次阶段性测试化学试卷(解析版) 题型:填空题
已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系:

(1)如果A、B、C、D均是1O电子的粒子。请写出A的电子式:______,D的结构式:_____。
(2)如果A、C均是18电子的粒子,B、D均是10电子的粒子。A与B在溶液中反应生成C和D的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省凯里市高三3月联考理综化学试卷(解析版) 题型:实验题
辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
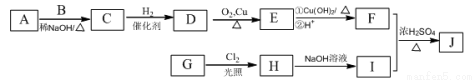
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③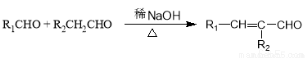
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com