
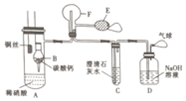
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个被固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个被固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球.分析 (1)一氧化碳极易被氧化,实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气;
(2)铜与稀硝酸反应生成无色气体一氧化氮和蓝色溶液硝酸铜;用E向F中鼓入空气后,烧瓶F内生成二氧化氮气体颜色加深,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,同时二氧化氮与水反应生成硝酸,碳酸钙又溶解于硝酸,所以沉淀又溶解;
(3)装置D是吸收尾气,防止产生大气污染.
解答 解:(1)实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,
故答案为:用碳酸钙与稀硝酸反应产生的二氧化碳赶走装置内的空气;
(2)铜与稀硝酸反应生成无色气体一氧化氮和蓝色溶液硝酸铜,所以现象为:有无色气体产生,一段时间后,装置A中溶液变蓝;用E向F中鼓入空气后,烧瓶F内生成二氧化氮气体颜色加深,反应的方程式为:2NO+O2=2NO2,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,同时二氧化氮与水反应生成硝酸,碳酸钙又溶解于硝酸,所以沉淀又溶解,现象为:白色沉淀溶解,
故答案为:有无色气体产生,一段时间后,装置A中溶液变蓝;2NO+O2=2NO2;白色沉淀溶解;
(3)装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,所以没有D装置,则造成的后果是污染大气,
故答案为:污染大气.
点评 本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.


科目:高中化学 来源: 题型:选择题
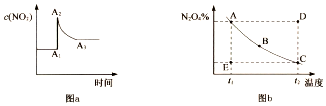
| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中可能含Na+ | B. | 该溶液中肯定含有NH4+、SO42-、Cl- | ||
| C. | 该溶液中一定不含NO3-、CO3- | D. | 该溶液中一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 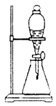 用图所示装置可以将乙醇和水分离 | |
| B. | 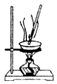 用图所示装置蒸发硫酸铜溶液制备硫酸铜晶体 | |
| C. | 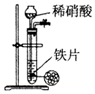 用图所示装置通过稀硝酸与铁反应制取少量的氢气 | |
| D. | 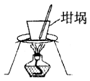 用图所示装置分离氢氧化钙固体中混有的少量氯化铵固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com