


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、用HNO3溶液完全中和后,溶液不显中性 |
| B、加水稀释后,溶液中c(NH4+)?c(OH-)变大 |
| C、与AlCl3溶液发生反应的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| D、其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
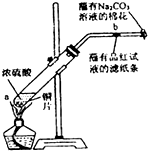 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
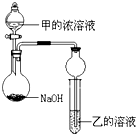 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
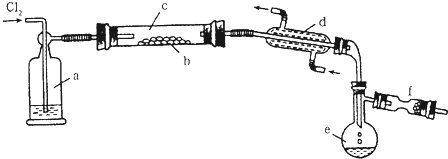
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
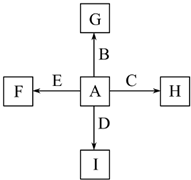 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往酸性KMnO4溶液中通入SO2验证SO2的还原性 |
| B、加热氯化铵与氢氧化钙固体混合物制取氨气 |
| C、用二氧化锰和稀盐酸反应制取氯气 |
| D、在溴水、碘水中加入四氯化碳以萃取其中的溴、碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com