
| A. | 硅原子和钠原子 | B. | 硼原子和氢原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
分析 B原子的L层电子数恰为A原子L层电子数的2倍,如为同周期元素,则都位于第二周期,不存在M层,可知A为第二周期,B为第三周期,结合电子数的关系可推断元素种类,以此解答该题.
解答 解:B原子的L层电子数恰为A原子L层电子数的2倍,如为同周期元素,则都位于第二周期,不存在M层,可知A为第二周期,B为第三周期,
L层最多排布8个电子,因此,B的L层有8个电子,而A的L层有4个电子(无M层),根据“A原子的M层比B原子的M层少3个电子”可知,B的M层上有3个电子,即A共有K、L电子层,排布的电子数分别为2、4,B共有K、L、M电子层,排布的电子数分别为2、8、3,故A是C,B是Al,
故选D.
点评 本题考查原子结构与元素周期表的关系,为高频考点,答题时要逐步确定A、B的电子层数和各层上的电子数,把排布规律与题意结合起来,整体把握,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
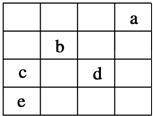 如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )| A. | 元素c和d的最高价氧化物对应水化物的酸性:c>d | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| D. | 元素c和e的气态氢化物的稳定性:c>e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比丁烷更易液化 | B. | 是石油分馏的一种产品 | ||
| C. | 光照下能够发生取代反应 | D. | 分子中碳原子一定在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com