
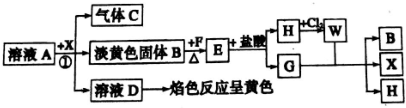
 ,G中化学键的类型为极性共价键;
,G中化学键的类型为极性共价键;分析 C为无色气体且能使品红溶液褪色,则C为SO2,F是生活中应用最广泛的金属单质,则F为Fe,气体G具有臭鸡蛋气味,则G为H2S,根据物质间的转化关系,淡黄色固体B应为S,硫与铁反应生成E为FeS,硫化亚铁与盐酸反应生成硫化氢气和H为FeCl2,氯化亚铁与氯气反应生成W为FeCl3,氯化铁与硫化氢反应生成硫单质、氯化亚铁和X为HCl,溶液D的焰色反应为黄色,则D中含有钠元素,A的摩尔质量为158g•mol-1,阳、阴离子的个数比为2:1,根据元素守恒可知A为Na2S2O3,D为NaCl,据此答题.
解答 解:C为无色气体且能使品红溶液褪色,则C为SO2,F是生活中应用最广泛的金属单质,则F为Fe,气体G具有臭鸡蛋气味,则G为H2S,根据物质间的转化关系,淡黄色固体B应为S,硫与铁反应生成E为FeS,硫化亚铁与盐酸反应生成硫化氢气和H为FeCl2,氯化亚铁与氯气反应生成W为FeCl3,氯化铁与硫化氢反应生成硫单质、氯化亚铁和X为HCl,溶液D的焰色反应为黄色,则D中含有钠元素,A的摩尔质量为158g•mol-1,阳、阴离子的个数比为2:1,根据元素守恒可知A为Na2S2O3,
(1)根据上面的分析可知,E为FeS,
故答案为:FeS;
(2)D为NaCl,D的电子式为  ,G为H2S,G中化学键的类型为极性共价键,
,G为H2S,G中化学键的类型为极性共价键,
故答案为: ;极性共价键;
;极性共价键;
(3)步骤①发生反应的离子方程式为S2O32-+2H+=SO2↑+S↓+H2O,
故答案为:S2O32-+2H+=SO2↑+S↓+H2O;
(4)FeCl3为强酸弱碱盐,铁离子水解,所以实验室用FeCl3固体来配制FeCl3溶液的操作为将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,
故答案为:将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度.
点评 本题考查无机物推断,物质的性质及转化中特殊反应为推断突破口,注意Mg与二氧化碳的反应,熟练掌握元素化合物性质.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液导电的一定是离子晶体 | |
| B. | 固态导电的一定是金属晶体 | |
| C. | 共价化合物形成的晶体一定是分子晶体 | |
| D. | 固态不导电、熔融态导电的一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
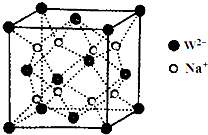 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
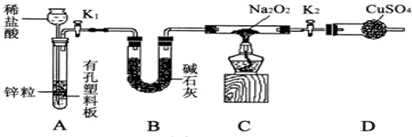 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com