
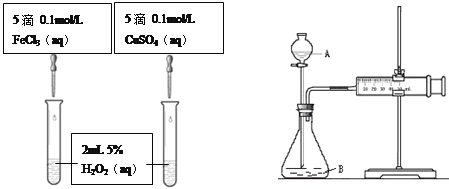
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象:_______________,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是_____________,你认为还可以作何改进?____________________。
图一 图二
(2)检查图二装置气密性的方法是_______________________。图二所示实验中需测量的数据是________________________。
【答案】反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 控制阳离子相同,排除阴离子的干扰 可将CuSO4改为CuCl2或将Fe Cl3改为Fe2(SO4)3 关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位(其它正确答案可酌情给分) 时间(或收集一定体积的气体所需要的时间)
【解析】
试题(1)可以通过观察产生气泡的快慢来定性比较比较Fe3+和Cu2+对H2O2分解的催化效果,将CuSO4改为CuCl2更为合理,这样Fe3+和Cu2+中的阴离子种类相同,可以排除因阴离子的不同可能带来的影响,还可以把氯化铁改为硫酸铁,故答案为产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;将氯化铁改为硫酸铁;
(2)结合乙图装置,该气密性的检查方法为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;反应是通过反应速率分析的,根据![]() ,实验中需要测量的数据收集一定体积的气体所需要的时间或一定时间内收集的气体体积;故答案为关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;收集一定体积的气体所需要的时间或一定时间内收集的气体体积。
,实验中需要测量的数据收集一定体积的气体所需要的时间或一定时间内收集的气体体积;故答案为关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;收集一定体积的气体所需要的时间或一定时间内收集的气体体积。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2min,以气体Z表示的平均反应速率为______________。
(3)平衡时X的转化率为_____________ 。
(4)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系内压强与开始时压强之比为________________;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________________(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生反应:A(g)+B(g)![]() 2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
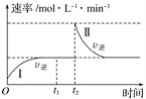
A.O~t2时,v正>v逆
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ
C.t2时刻改变的条件是向密闭容器中加C
D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应与能量的说法正确的是
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
B.CaCO3(s)![]() CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
D.H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的ZnSO4和CuSO4的混合溶液中,逐滴加入1.5 mol·L1的Na2S溶液直至溶液中无沉淀产生,然后过滤。已知:Ksp(ZnS)=2.0×1022,Ksp(CuS)=1.3×1036。下列说法不正确的是
A.先生成CuS后生成ZnS沉淀,属于沉淀的转化
B.当ZnS沉淀完全时,溶液中![]() =6.5×1015
=6.5×1015
C.过滤得到的沉淀是CuS和ZnS的混合物
D.过滤后得到的溶液中仍有极少量的Cu2+和Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法中,错误的是( )。
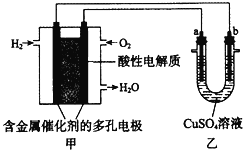
A.燃料电池中通入氢气一端的多孔电极为负极
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4 OH-
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.乙装置可实现将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铜-锌原电池示意图。下列有关该原电池的描述中正确的是( )

A.锌片作正极,不断溶解
B.铜片作负极,有气泡产生
C.负极反应:Zn2++2e-=Zn
D.正极反应:2H++2e-=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com