
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(1)①Ⅰ ②< ③80% 250 ℃
(2)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-1
【解析】(1)①反应Ⅰ的产物只有甲醇,而反应Ⅱ的产物有两种,故反应Ⅰ符合“原子经济”原则;②观察图表数据可得,升温时,K值变小,说明该反应的正反应为放热反应,即ΔH1<0;③CO的转化率为(2 mol-0.2 mol·L-1×2 L)/2 mol×100%=80%;此时的化学平衡常数为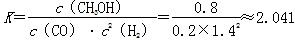
故此时的温度为250 ℃。(2)将三个热化学方程式进行变形:[①+(-②)+4×③]×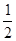 ,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×
,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×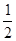 =-442.8 kJ·mol-1。
=-442.8 kJ·mol-1。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分,下列判断正确的是:

A.步骤①③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是裂化汽油或乙醇
D.步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.Na+、Ba2+、Cl-、NO3- B.Pb2+、Hg2+、S2-、SO42-
C.NH4+、H+、S2O32-、PO43- D.Ca2+、Al3+、Br-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
下列过程中,没有明显现象变化的是
A.向饱和碳酸钠溶液中通入CO2气体
B.SO3通入BaCl2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液
D.向Fe(NO3)2溶液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列有关物质的性质和应用均正确的是
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S 稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
图甲中电极均为石墨电极,下列叙述中正确的是

A.电子沿a→d→c→d路径流动
B.b极的电极反应为O2+4e-+4H+=2H2O
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑
CuSO4+H2↑
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com