
【题目】下列离子方程式中,错误的是( )
A. 钠和冷水反应:2Na+2H2O═2Na++2OH﹣+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++4OH﹣═AlO2﹣+2H2O
C. 将氯气通入水中:Cl2+H2O![]() Cl﹣+HClO+H+
Cl﹣+HClO+H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
科目:高中化学 来源: 题型:
【题目】【贵阳市第一中学2017届下学期第六次适应性考试】U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
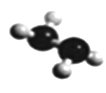
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为_______。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的的是
A.乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液
B.乙醇(水):加入新制生石灰,蒸馏
C.乙酸(乙醇):加入金属钠,蒸馏
D.苯(液溴):加入NaOH溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【湖南省2017年考前演练卷(三)】利用下列实验装置进行相应的实验,不能达到实验目的的是
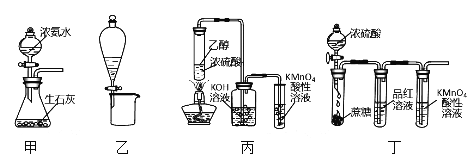
A.利用图甲装置,可快速制取氨气
B.利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C.利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D.利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①![]()
② ![]()
回答下列问题:
(1)A的化学名称是_________________。
(2)E的结构简式为______________________________。
(3)G为甲苯的同分异构体,由F生成H的化学方程式为_____________________。
(4)由C生成D和E生成F的反应类型分别是________、_________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出![]() ,其核磁共振氢谱显示有
,其核磁共振氢谱显示有![]() 种不同化学环境的氢,峰面积为
种不同化学环境的氢,峰面积为![]() ,写出
,写出![]() 种符合要求的X的结构简式____________、____________。
种符合要求的X的结构简式____________、____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线_______(其他试剂任选)。
的合成路线_______(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣活动小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5mL溶液a于试管中,滴入两滴酚酞 | i.溶液变红 ii.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式:_______________________________。
(2)ii中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
I.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂___________(填化学式),有气体产生。
II.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.mL溶液a,用稀H2SO4酸化,逐滴加入0.003 mol/L KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液。
①请配平:_MnO4-+_H2O2+_____===_Mn2++_O2↑+_H2O
②溶液a中 c(H2O2)=_____mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是__________________________。
(3)为探宄现象ii产生的原因,同学们继续进行了如下实验:
iii.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1 mol·L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
IV.向0.l mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验III和IV中,可得出的结论是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将31.8gNa2CO3固体溶于水配成体积为1L的溶液,回答下列问题:
(1)该溶液中含有CO32-的数目是______________,Na+的浓度是___________mol/L
(2)现有某浓度的浓盐酸,该盐酸的密度d=1.2g/cm3,质量分数w = 36.5%,计算该盐酸的物质的量浓度是__mol/L。
(3)欲将题干中的Na2CO3完全反应生成CO2气体,则至少需要(2)中的盐酸_________mL,生成的CO2气体的体积是_________mL (标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K______ (填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为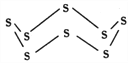 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为________,N2的沸点比CO的沸点____(填“高”或“低”)。
(5)K2S的晶胞结构如图所示。其中K+的配位数为_______,S2-的配位数为____;若晶胞中距离最近的两个S2-核间距为a cm,则K2S晶体的密度为____g·cm-3(列出计算式,不必计算出结果)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com