
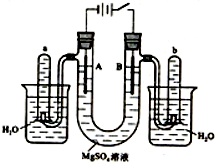
 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:分析 (1)电解时,阳极上氢氧根离子放电,同时电极附近有氢离子生成,溶液呈酸性;阴极上氢离子放电生成氢气,同时电极附近有氢氧根离子生成,溶液呈碱性,根据指示剂和酸碱的反应确定溶液颜色;
(2)A中氢离子放电生成氢气,同时电极附近生成氢氧根离子,氢氧根离子和镁离子生成白色沉淀;
(3)B管中氢氧根离子放电生成氧气;
(4)氢气能燃烧,接近火焰会产生爆鸣声,且氢气燃烧产生蓝色火焰;
(5)氧气能使带火星的木条复燃;
(6)电解一段时间后,溶液呈酸性,氢氧化镁能溶于酸.
解答 解:(1)电解时,B管阳极上氢氧根离子放电,同时电极附近有氢原子生成,溶液呈酸性,所以溶液呈红色;A管阴极上氢离子放电生成氢气,同时电极附近有氢氧根离子生成,溶液呈碱性,溶液呈黄色,
故答案为:①④;
(2)A管中氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,同时电极附近有氢氧根离子生成,氢氧根离子和镁离子生成氢氧化镁白色沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:2H++2e-=H2↑、Mg2++2OH-=Mg(OH)2↓;
(3)B管中氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(4)a管中收集的气体是氢气,氢气具有可燃性,其检验方法为:用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰,
故答案为:用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰;
(5)b管中收集的气体是氧气,氧气能使带火星的木条复燃,其检验方法为:用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内会复燃,
故答案为:用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内会复燃;
(6)将电解液倒入烧杯中,溶液中含有硫酸,溶液呈酸性,所以溶液为红色,A管生成的氢氧化镁能溶于稀硫酸,所以看到的现象是:溶液呈红色,白色沉淀溶解,
故答案为:溶液呈红色,白色沉淀溶解.
点评 本题考查了电解原理,根据各个电极上发生的电极反应及溶液的酸碱性来分析解答,注意A管中不仅有氢气生成,还产生白色沉淀,为易错点.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
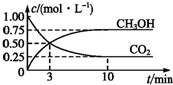 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和氯离子都呈黄绿色 | |
| B. | 干燥的氯气和新制氯水都能使鲜艳的干红花褪色 | |
| C. | 常温下,液氯可以用钢瓶盛装 | |
| D. | 新制的氯水应该保存在无色的玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3 | B. | CH2=CH-CH2-CH2-CH3 | ||
| C. | CH2=CH-CH2-CH=CH2 | D. | CH2=CH-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验目的或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
| B | 将某气体通入品红溶液,溶液褪色 | 检验气体中的SO2 |
| C | 测定等物质的量浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| D | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com