
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
【答案】 FeO42- +4 H2O+3e- = Fe(OH)3+5 OH- 0.2 工作时间长工作电压稳定。 3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O +6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物。
【解析】试题分析:(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,左边烧杯只能生成三价铁,三价铁离子在碱溶液中沉淀下来;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定 ;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平方程式;(3)+6价铁具有强氧化性,氢氧化铁胶体吸附水中悬浮物;
解析:(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,左边烧杯只能生成三价铁,三价铁离子在碱溶液中沉淀下来;正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;若维持电流强度为1A,电池工作十分钟,通过电子为![]() ,则理论消耗Zn为
,则理论消耗Zn为![]() 0.2g;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平,反应离子方程式是3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O;(5) K2FeO4中+6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物,所以K2FeO4能消毒、净水。
0.2g;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平,反应离子方程式是3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O;(5) K2FeO4中+6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物,所以K2FeO4能消毒、净水。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】用下图表示的一些物质或概念间的从属关系中正确的是
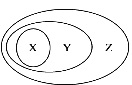
X | Y | Z | |
A | 水 | 单质 | 纯净物 |
B | 非金属氧化物 | 酸性氧化物 | 氧化物 |
C | 电解质 | 化合物 | 纯净物 |
D | 化合反应 | 氧化还原反应 | 化学反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
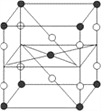
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)经过5min后,反应达到平衡,此时转移电子6mol。该反应的平衡常数为_______。V(H2)=_____mol/(L·min)。若保持体积不变,再充入2mulCO和1.5mol CH3OH,此时v(正)___ v(逆)(填“>”“<”或“=”)。
(2)在其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率____(填“增大”“减小”或“不变”)。
(3)下列不能说明该反应已达到平衡状态的是__________
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.V逆(CO)=2V正(H2) d.混合气体的密度不再发生改变
(4)在一定压强下,容积为VL的容器充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
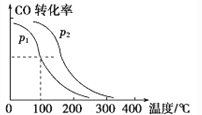
则p1_____p2(填“大于”“小于”或“等于”,下同),△H_____0。该反应在_______(填“高温”或“低温”)下能自发进行。
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离除CH3OH气体 b.适当升高温度
c.增大H2的浓度 d.选择高效催化剂
(6)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______。
a.化学反应速率理论可指导怎样在一定时间内快出产品
b.有效碰撞理论可指导怎样提高原料的转化率
c.勒夏特列原理可指导怎样使用有限原料多出产品
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
A. 羰基硫的电子式为: :![]() :
:![]() :
:![]() :
:
B. 通入CO后,正反应速率逐渐增大
C. 再加入0.1molH2S和0.1molH2,平衡不移动
D. 反应前H2S物质的量为0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铜 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是____________________________________。
(2)属于电解质的是__________________________________________。
(3)属于非电解质的是____________________________________。
(4)②在水溶液中的电离方程式为_____________________,①与②在溶液中反应使溶液呈中性的离子方程式为_______________________。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是________。
II.当有2 mol HNO3参加反应时,被氧化的物质的质量为________g。
III.用双线桥表示该反应电子转移的方向和数目_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com