
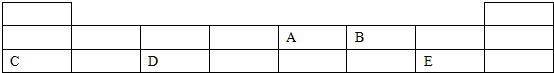
 ;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).
;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).分析 由元素在短周期中的位置,可知A为N元素、B为O元素、C为Na、D为Al、E为Cl元素.
(1)A的单质为N2,分子中N原子之间形成3对共用电子对;B元素处于第二周期ⅥA族;同周期随原子序数增大,元素非金属性增强;
(2)C的最高价氧化物水化物为NaOH,氢氧化钠与氯气反应生成NaCl、NaCl和H2O,E的最高价氧化物水化物的名称是高氯酸.
解答 解:由元素在短周期中的位置,可知A为N元素、B为O元素、C为Na、D为Al、E为Cl元素.
(1)A的单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ;B元素处于第二周期ⅥA族;同周期随原子序数增大,元素非金属性增强,故非金属性A<B,
;B元素处于第二周期ⅥA族;同周期随原子序数增大,元素非金属性增强,故非金属性A<B,
故答案为: ;第二周期ⅥA族;弱;
;第二周期ⅥA族;弱;
(2)C的最高价氧化物水化物为NaOH,含有离子键、共价键,氢氧化钠与氯气反应生成NaCl、NaCl和H2O,反应离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,E的最高价氧化物水化物的名称是高氯酸,
故答案为:离子键、共价键;2OH-+Cl2=Cl-+ClO-+H2O;高氯酸.
点评 本题考查元素周期表与元素周期律,题目难度不大,旨在考查学生对基础知识的理解掌握,注意整体把握元素周期表.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | D元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:B>D>E | |
| C. | B、C两种元素的气态氢化物中,C的气态氢化物较稳定 | |
| D. | A与B形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在一条直线上 | |
| B. | 分子中最多有12个原子在同一平面上 | |
| C. | 6个碳原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
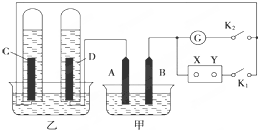 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复合材料一定是由两种或两种以上材料制成的 | |
| B. | 复合材料既保持了原材料的优点,又有优于原材料的特点 | |
| C. | 在复合材料中,增强体起骨架作用 | |
| D. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某工业废水中加入过量浓溴水 | 产生白色沉淀 | 该废水中可能含有苯酚 |
| B | 向溴乙烷中滴加硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 某有机物中加入金属Na | 产生气泡 | 该物质为乙醇 |
| D | 乙醇与浓硫酸共热,将产生的气体通入溴水中 | 溴水褪色 | 该气体一定为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | BaCl2 | KOH |
| pH值变化 | 减小 | 增大 | 变大 | 不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的百分含量不变 | B. | N2的体积分数增大 | ||
| C. | N2的转化率增大 | D. | NH3的百分含量增小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com