
分析 (1)氧化还原反应的本质是电子转移;在氧化还原反应中失电子化合价升高的反应物的还原剂,在反应中发生氧化反应;
(2)氯气和NaOH反应生成NaCl、NaClO和水;
(3)A.1L溶液中含有0.1molNa2CO3;
B.10.6g碳酸钠的物质的量是0.1mol,1L溶液中含有10.6g Na2CO3,根据C=$\frac{n}{V}$计算其物质的量浓度;
C.将10.6g Na2CO3溶于水配成1L溶液,所得溶液物质的量浓度的0.1mol/L;
D.根据n=CV结合物质构成计算;
(4)A.钠性质很活泼,极易和空气中氧气、水反应;
B.钠能和水反应生成氢气;
C.钠密度大于煤油和石蜡,且和煤油、石蜡不反应;
D.过氧化钠和水反应生成氢氧化钠和氧气,同时放出大量热;
(5)A.氯化钙溶液与碳酸钠溶液反应,二者生成碳酸钙沉淀;
B.漏掉生成氢氧化铜的反应;
C.氢氧化镁与稀盐酸反应生成氯化镁和水;
D.氢氧化钡溶液与盐酸的反应生成弱电解质水;
E.电荷不守恒;
F.碳酸钙溶于稀盐酸,二者反应生成可溶性氯化钙、二氧化碳和水.
解答 解:(1)氧化还原反应的本质是电子转移;在氧化还原反应中失电子化合价升高的反应物的还原剂,在反应中发生氧化反应,被氧化,故答案为:电子转移;还原;氧化;
(2)氯气和NaOH反应生成NaCl、NaClO和水,离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(3)A.1L溶液中含有0.1molNa2CO3,而不是1L水中含有0.1mol碳酸钠,故A错误;
B.10.6g碳酸钠的物质的量是0.1mol,1L溶液中含有10.6g Na2CO3,根据C=$\frac{n}{V}$知,其物质的量浓度是0.1mol/L,故B正确;
C.将10.6g Na2CO3溶于水配成1L溶液,所得溶液物质的量浓度的0.1mol/L,溶于1L水导致溶液体积大于1L,其浓度小于0.1mol/L,故C错误;
D.钠离子n=2×0.1mol/L×1L=0.2mol,故D正确;
故选BD;
(4)A.钠性质很活泼,极易和空气中氧气、水反应,所以钠元素在自然界中都是以化合态存在,故A正确;
B.钠能和水反应生成氢气,所以不能用湿布盖灭,应该用沙土盖灭,故B错误;
C.钠密度大于煤油和石蜡,且和煤油、石蜡不反应,钠极易和水、氧气反应,所以应该用煤油、石蜡贮存钠,故C正确;
D.过氧化钠和水反应生成氢氧化钠和氧气,氧气具有助燃性,同时放出大量热,所以剩余的过氧化钠不能随便丢弃,故D错误;
故选AC;
(5)A.氯化钙溶液与碳酸钠溶液反应,二者生成碳酸钙沉淀,离子方程式为Ca2++CO32-=CaCO3↓,故A正确;
B.漏掉生成氢氧化铜的反应,离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故B错误;
C.氢氧化镁与稀盐酸反应生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故C正确;
D.氢氧化钡溶液与盐酸的反应生成弱电解质水,离子方程式为OH-+H+=H2O,故D正确;
E.电荷不守恒,离子方程式为Cu+2Ag+=Cu2++2Ag,故E错误;
F.碳酸钙溶于稀盐酸,二者反应生成可溶性氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故F正确;
故选BE.
点评 本题考查离子方程式书写、离子方程式正误判断、氧化还原反应、物质的量浓度等知识点,综合性较强,侧重考查学生分析判断及计算能力,难点是离子方程式正误判断,要遵循原子守恒、电荷守恒及转移电子守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 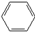 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$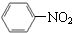 +H2O +H2O | |
| D. | CH3COOH+HOCH2CH3$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
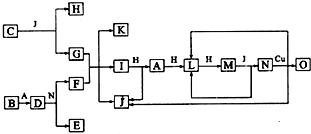
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl溶液中的少量I2:用无水乙醇,萃取分液 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,洗气 | |
| C. | 除乙烷中混有的少量乙烯:将气体通过酸性高锰酸钾溶液洗气 | |
| D. | 除去溴苯中混有的少量苯:蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用新制Cu(OH)2悬浊液检验乙醛中醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com