
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度mol•L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol•L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | - | - | - |
分析 (1)氮的化合价降低,所以反应氧化剂是N2,3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),每转移1mol eˉ放出132.6kJ的热量,化学方程式中电子转移12mol,放热1591.2KJ;
(2)根据平衡状态的特征分析解答;
(3)正反应方向是放热反应和气体体积增大的方向,结合平衡移动的影响因素分析解答;
(4)温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行,所以该反应的温度控制在1300-1700°C;
(5)依据化学反应速率概念计算,根据平衡常数列式计算.
解答 解:(1)氮的化合价降低,所以反应氧化剂是N2,3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),每转移1mol eˉ放出132.6kJ的热量,化学方程式中电子转移12mol,放热1591.2KJ,故答案为:N2,-1591.2 kJ/mol;
(2)A.焦炭的质量不再变化,说明正逆反应速率相等,达平衡状态,故A正确;
B.只要反应发生,N2 和CO速率之比就为1:3,所以不一定平衡,故B错误;
C.生成6molCO等效于生成1mol Si3N4同时消耗1mol Si3N4,正逆反应速率相等,达平衡状态,故C正确;
D.混合气体的密度不再变化,说明气体的质量不变反应达平衡状态,故D正确;
故选:ACD;
(3)A.升高温度,平衡逆向移动,故不选;
B.降低压强,平衡正向移动,故选;
C.加入更多的SiO2,平衡不移动,故不选;
D.充入N2,平衡正向移动,故选;
故选:BD;
(4)温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行,所以该反应的温度控制在1300-1700°C,故答案为:温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行;
(5)在2L的密闭容器中,测得该反应中N2和CO各个时刻的物质的量,分析数据结合反应速率概念,v(N2)=$\frac{4mol/L-3.26mol/L}{20min}$=0.037mol/L•min;
3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),
起始量(mol/L) 4 0
变化量(mol/L) 1 3
平衡量(mol/L) 3 3
平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$=$\frac{{3}^{6}}{{3}^{2}}$=81.0;
故答案为:3.70×102 mol/(L•min);81.0.
点评 本题考查了化学平衡影响因素分析判断,反应速率计算,平衡常数计算应用,题目难度较大,但综合性强.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX、HY、HZ | B. | HX、HZ、HY | C. | HZ、HY、HX | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3 | |
| B. | Cl2和H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NO2通入水中:H2O+3NO2═2H++2NO3-+NO | |
| D. | 浓盐酸和二氧化锰共热制Cl2:MnO2+4H++2Cl-═Mn2++Cl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
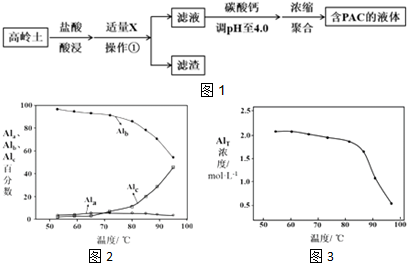
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙 | 过滤 |
| B | NaCl溶液 | NaBr | 稍过量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液 | 过滤 |
| D | O2 | CO | 氧化铜 | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com