
下列分类依据和结论都正确的是( )
A.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸
B.H2O、Na2O2、HClO均含有氧元素,都是氧化物
C.HF、NH3、CH3CH2OH都易溶于水,都是电解质
D.碱性氧化物都是金属氧化物,因此金属氧化物都是碱性氧化物
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(解析版) 题型:选择题
在2A+B  3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次月考化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电 解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
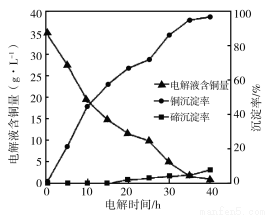
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
把aLAl2(SO4)3和(NH4) 2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
A. B.
B.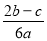 C.
C.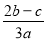 D.
D.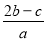
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.氧化亚铁溶于稀硝酸:FeO + 2H+ == Fe2+ + H2O
B.往CaCl2溶液中通入少量的CO2: Ca2++CO2+H2O=CaCO3↓+2H+
C.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3- + OH-=CO32-+ H2O
D.向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
①CaCO3 (s)=CaO+CO2(g);ΔH=177.7kJ/mol
(s)=CaO+CO2(g);ΔH=177.7kJ/mol
②C(s)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol
③1/2H2SO4(l)+NaOH(l)=1/2Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol
④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
⑤CO(g)+1/2O2(g)=CO2(g);ΔH=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol
⑦2H2(g)+O2(g)=2H2O(l);ΔH=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有( )
(2)根据上述信息,写出C转化为CO的热化学方程式___________________。
(3)上述正确的反应中,表示燃烧热的热化学方程式有( );
(4)表示中和热的热化学方程式有( )。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:选择题
白磷与氧可发生如下反 应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。
应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d-4c-1 2b)kJ·mol—1 B.(4c+12b-6a-5d)kJ·mol—1
2b)kJ·mol—1 B.(4c+12b-6a-5d)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g) +CO(g) COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
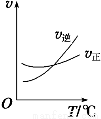

A.0~6 min内,反应的平均速率v(Cl2)=0.15 mol ·L-1·min -1;
B.若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动;
C. 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) >T(15)。
D.若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上第一次大考化学卷(解析版) 题型:选择题
关于下列各装置图的叙述中,正确的是( )

A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com