
| ���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| ��ʼ����pH | 6.0 | 7.5 | 1.4 |
| ������ȫpH | 13 | 14 | 3.7 |

���� ��1������1Ϊ�������������ܽ������������������������ػᷢ����Ӧ����Ѫ��ɫ��Һ��
��2���μ�KSCN�Լ�����Һ�����ɫ��˵����Һ���������ӣ�������������ͭ�����з���������ԭ��Ӧ��������ͭ��ͭ�����ɵ�ͭ�ܰ������ӻ�ԭΪ�������ӣ�ʹ��Һ����������ز����ɫ��
��3��������ȫ�ܽ⣬������ڣ�˵�����庬����������������ͭ����Ӧ���ɵ�ͭ���������ȫ����Ӧ��
��4��Cu2O�ڿ����м�������CuO������2Cu2O+O2$\frac{\underline{\;\;��\;\;}}{\;}$4CuO�������ӵ�����Ϊ�μӷ�Ӧ��������������
��5���ٺ�ɫ��ĩΪFe2O3��Cu2O�Ļ�������������������ͭ��Ӧ���ɵ�ͭ�ỹԭ������Ϊ�������ӣ�������������������������������Ϊ�����ӣ�������ҺPHʹ������ȫ��������
��X��������������
��� �⣺��1��ȡ������ĩ��������ϡ�����У���������Һ���ٵμ�KSCN�Լ���������1��������ɫ��ĩ��Fe2O3����ʵ�������ǹ�����ȫ�ܽ⣬��Һ��Ѫ��ɫ��
�ʴ�Ϊ��������ȫ�ܽ⣬��Һ��ΪѪ��ɫ��
��2���μ�KSCN�Լ�����Һ�����ɫ��˵����Һ���������ӣ�������������ͭ�����з���������ԭ��Ӧ��������ͭ��ͭ�����ɵ�ͭ�ܰ������ӻ�ԭΪ�������ӣ�ʹ��Һ����������ز����ɫ�����Եμ�KSCN�Լ�����Һ�����ɫ������˵��ԭ����ﲻ��������������������
�ʴ�Ϊ����������
��3��������ȫ�ܽ⣬������ڣ�˵�����庬����������������ͭ����Ӧ���ɵ�ͭ���������ȫ����Ӧ����Ӧ�����ӷ���ʽΪCu2O+2H+�TCu+Cu2++H2O��2Fe3++Cu�T2Fe2++Cu2+��
�ʴ�Ϊ��Fe2O3��Cu2O�Ļ���Cu2O+2H+�TCu+Cu2++H2O��2Fe3++Cu�T2Fe2++Cu2+��
��4��Cu2O�ڿ����м�������CuO������2Cu2O+O2$\frac{\underline{\;\;��\;\;}}{\;}$4CuO����������Cu2O������Ϊx����
2Cu2O+O2$\frac{\underline{\;\;��\;\;}}{\;}$4CuO
288 32
x ��b-a��
x=9��b-a��g��
�������Cu2O����������Ϊ$\frac{9��b-a��}{a}$��100%��
�ʴ�Ϊ��$\frac{9��b-a��}{a}$��100%��
��5����ɫ��ĩΪFe2O3��Cu2O�Ļ�������������������ͭ��Ӧ���ɵ�ͭ�ỹԭ������Ϊ�������ӣ�������������������������������Ϊ�����ӣ�������ҺPHʹ������ȫ��������Ϊ������������Ҫ��������ͭ���ʽ̼��ͭ������ҺPH��AC�������µ����ʣ�
��������������֪���Լ�IΪB���Լ�IIΪF���ʴ�Ϊ��B��F��
�ڹ���XΪ����������������ѧʽΪFe��OH��3���ʴ�Ϊ��Fe��OH��3��
���� ���⿼�����ʺ����ⶨ�����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬�������ʵ����ʡ������ķ�Ӧ�������еķ��뷽��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ѧ����ʽ�еĻ�ѧ��������ʾ���ʵ����������Ƿ��� | |
| B�� | Ӧ�ø�˹���ɿɼ���ijЩ����ֱ�Ӳ����ķ�Ӧ�ʱ� | |
| C�� | ��֪C��ʯī��s���TC�����ʯ��s����H��0������ʯ��ʯī�ȶ� | |
| D�� | ��֪2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ/mol����������ȼ����Ϊ285.8kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
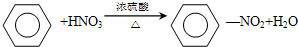 ���÷�Ӧ��������ȡ����Ӧ��
���÷�Ӧ��������ȡ����Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ? ?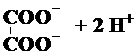 | B�� | Ba��OH��2?Ba2++2OH- | ||
| C�� | HCO3-+H2O?H3O++CO32- | D�� | NaHCO3�TNa++H++CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��������Ũ���Cu+2NO3-+4H+�TCu2++2NO2��+2H2O | |
| B�� | ������������ϡ�����У�FeO+2H+=Fe2++H2O | |
| C�� | ��ˮ���չ�����SO2��OH-+SO2=HSO3- | |
| D�� | ̼������ڴ����У�CaCO3+2H+=Ca2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0.5mol/L���� | B�� | ����ˮ | ||
| C�� | 0.5mol/L���� | D�� | 0.5mol/L �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij��Һ�м���ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ���ԭ��Һ��һ����CO32- | |
| B�� | ��ij��Һ�м����Ȼ�����Һ�а�ɫ�����������ټ�ϡ���ᣬ��������ʧ����ԭ��Һ��һ����Ag+ | |
| C�� | ��ij��Һ���ȼ��������ữ��û�����������ټ���BaCl2��Һ���а�ɫ������������ԭ��Һ��һ����SO42- | |
| D�� | ��ij��Һ�м������̼������Һ������ɫ�������ټ������ɫ������ʧ����ԭ��Һһ����Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��
ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com