
| A、小于0.9mol |
| B、等于0.9mol |
| C、在0.9mol与1.8mol之间 |
| D、等于1.8mol |
| ||
| ||
| 0.10L×18mol/L |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| A、有单质生成的反应一定是氧化还原反应. |
| B、食用油长期放置后有难闻气味,是因为油脂发生了水解反应 |
| C、离子反应中一定有离子种类或离子浓度的变化. |
| D、钢铁生锈过程中,四个基本反应类型均有发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA |
| B、精炼铜过程中阳极减轻6.4g时,电路中转移电子数等于0.2NA |
| C、2gD216O中含中子、质子、电子数目均为NA |
| D、标准状况下,11.2L NO和O2的混合气体所含有的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、由甲烷的氯代物有4种,可推知乙烷的氯代物有6种 |
| C、乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 |
| D、光照下,新戊烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
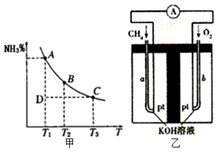 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.| c(H+) |
| c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com