
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
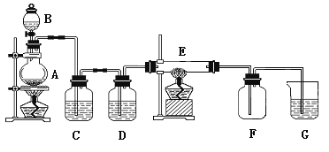
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去氯气中混有的氯化氢 干燥氯气 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 除去氯气中混有的氯化氢 干燥氯气 2Fe+3Cl2![]() 2FeCl3 吸收多余的氯气
2FeCl3 吸收多余的氯气
【解析】
在加热条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水;浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水吸收氯化氢;D中含有浓硫酸,浓硫酸具有吸水性,能作干燥剂;在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁;氯气密度大于空气且常温下和空气不反应,可以采用向上排空气法收集氯气;氯气有毒不能直接排空,可以用碱性物质吸收氯气,据此解答。
(1)加热条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水的作用是除去氯气中混有的氯化氢;浓硫酸具有吸水性而干燥氯气;在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)氯气有毒不能直接排入空气中,氯气和碱性物质反应生成无毒物质,所以E装置的作用是吸收多余的氯气,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:
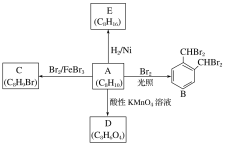
⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
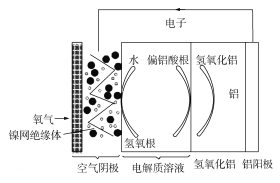
下列说法错误的是
A. 若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+6H2O+4OH=4Al(OH)4-
B. 若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C. 如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D. 若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:
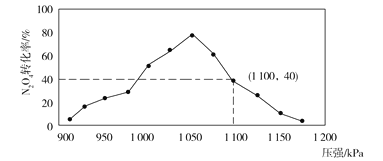
在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。
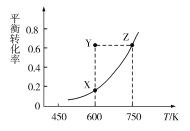
A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙醇和丙三醇互为同系物
B. 环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C. 分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D. 二环己烷( ![]() )的一氯代物有3种结构(不考虑立体异构)
)的一氯代物有3种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是

A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com