
A、c(Na+)=c(HCO
| ||||
B、c(Na+)+c(H+)=c(HCO
| ||||
C、HCO
| ||||
| D、发生的化学反应是:2NaOH+CO2=Na2CO3+H2O |
| 1.12L |
| 22.4L/mol |
| 2g |
| 40g/mol |
| 1.12L |
| 22.4L/mol |
| 2g |
| 40g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Zn+H2SO4=ZnSO4+H2↑ |
| B、2Na+H2=2NaH |
| C、NH3+HCl=NH4Cl |
| D、CO2+2NH2=CO(NH2)2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和乙醇 |
| B、丙烷和乙酸乙酯 |
| C、甲烷和乙酸 |
| D、乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤编号 | 实验步骤及预期现象和结论 |
| ① | |
| ② | |
| ③ | |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液和醋酸的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、KOH溶液和盐酸反应 |
| D、NaHCO3和NaOH的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
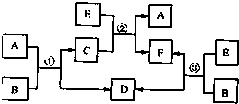 A、B、C、D、E、F六种物质在一定条件下的相互转化关系.如图所示(所有反应物和生成物均已给出).
A、B、C、D、E、F六种物质在一定条件下的相互转化关系.如图所示(所有反应物和生成物均已给出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com