
分析 (1)第4分钟时达到平衡,生成NH3为0.4mol,根据v=$\frac{△c}{△t}$计算v(NH3);
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
正反应为放热反应,降低温度平衡正向移动,平衡常数增大;
(3)体积减小,气体压强增大,平衡向气体体积减小的方向移动;
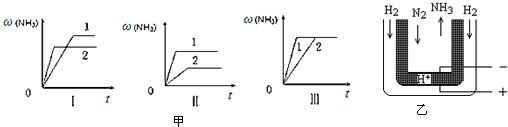
(4)a.增大压强反应速率加快,平衡右移;
b.升高温度反应速率加快,平衡逆向移动;
c.使用催化剂,不影响平衡移动,催化剂性能越大,反应速率越快;
(5)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气.
解答 解:(1)第4分钟时达到平衡,生成NH3为0.4mol,达到平衡时氨气浓度增加了$\frac{0.4mol}{4L}$=0.10mol/L,v(NH3)=$\frac{0.1mol/L}{4min}$=0.025 mol•L-1•min-1,
故答案为:0.025 mol•L-1•min-1;
(2)N2(g)+3H2(g)?2NH3(g)的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{3})}$,正反应为放热反应,降低温度平衡正向移动,平衡常数增大,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{3})}$;增大;
(3)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,
故答案为:向正反应方向;
(4)a.增大压强反应速率加快,故压强p2>p1,但平衡正向移动,氨气体积分数增大,图象与实际不符,故a错误;
b.升高温度反应速率加快,到达平衡时间缩短,故温度T2>T1,正反应为放热反反应,升高温度平衡逆向移动,氨气体积分数应减小,图象与实际不符,故b错误;
c.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故c正确,
故选:c;
(5)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气,阴极电极反应式为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
点评 本题考查化学平衡的计算与影响因素、化学平衡图象、电解原理等,题目难度中等,(4)中注意利用先拐先平数值大原则与定二议一法分析图象.


科目:高中化学 来源: 题型:选择题
| A. | Na+0.6mol/L | B. | CO32- 0.2 mol/L | C. | Mg2+0.4 mol/L | D. | Ba2+0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑥ | C. | ② | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 达到平衡时,容器I中的CH3OH体积分数与容器Ⅱ相等 | |
| B. | 容器I中反应的平衡常数K=0.08 | |
| C. | 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向逆反应方向进行 | |
| D. | 容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雪是由水蒸气凝华而成的,该过程有能量放出 | |
| B. | 雪融化为水后能量增加 | |
| C. | 雪融化为水时要吸收能量,导致环境温度升高 | |
| D. | 在雪上撒大量的盐(如NaCl、MgCl2等)可以融雪 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com