
下列措施能够减缓反应速率的是( )
A.将铜与稀硝酸反应的试管浸入热水
B.夏天将牛奶放入冰箱冷藏防止变质
C.将石灰石研碎后与稀盐酸反应制取二氧化碳
D.增大2A(g)+B(g) 3C(g)+4D(g)体系中A的浓度
3C(g)+4D(g)体系中A的浓度
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知:① 2CO(g)+O2(g) 2CO2(g) △H=-566kJ/mol;
2CO2(g) △H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是

A.CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g
B.如上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO的燃烧热为-566 kJ/mol
【答案】A
【解析】
试题分析:A.将①×1/2+②,整理可得CO(g)+Na2O2(s)= Na2CO3(s) △H=-509kJ/mol,即1molCO发生该反应放出热量是509kJ,现在放出热量就是509kJ,则消耗CO的物质的量是1mol,其质量是28g,正确; B.CO生成CO2的反应是放热反应,反应物的能量,图示没有注明物质的状态,不能体系能量变化关系,错误;C.根据反应可知2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ/mol,若CO2是固体,由于能量比气体低,反应放出的热量小于452 kJ,故2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452 kJ/mol,错误;D.燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,根据①可知CO的燃烧热是-283kJ/mol,错误。
考点:考查反应热的有关计算的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
在一定温度下,可逆反应2A(g)+B(g)  C(g)+D(g)达到平衡状态的标志是
C(g)+D(g)达到平衡状态的标志是
A.C的生成速率和B的消耗速率相等
B.v正(A)=2v正(B)
C.2v正(A)=v逆(B)
D.反应混合物中A、B、C、D的质量分数不再发生变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:填空题
下表是元素周期表中部分元素,请回答下列问题:
| IA | IIA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
1 | H |
|
|
|
|
|
| He |
2 | Li |
|
| C | N | O | F |
|
3 | Na |
| Al | Si |
| S | Cl |
|
(1)上表所列元素中,属于金属元素的有_____种,金属性最强的元素与氧反应生成的化合物有Na2O和________(填化学式)。
(2)上表所列元素中,化学性质最不活泼的是_____,非金属性最强的元素形成的单质的电子式为__________。
(3)N、C、Si三种元素的气态氢化物中,最稳定的是______(化学式)。
(4)上表所列的第三周期的元素中,原子半径最小的是_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
苯与乙烯相比较,下列叙述正确的是( )
A. 都容易发生取代反应
B. 都能在空气中燃烧
C. 苯不能发生加成反应
D. 苯能被KMnO4氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
关于元素周期律和元素周期表的下列说法,正确的是( )
A. 目前的元素周期表已完善,不可能再有新元素被发现
B. 元素的性质随原子序数的增加而呈周期性变化
C. 化学家道尔顿为元素周期表的建立作出了最巨大贡献
D. 同一主族的元素从上到下,金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:推断题
以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
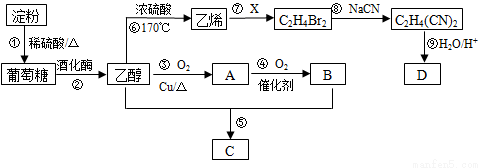
请回答下列问题:
(1)A的结构简式为 ,B分子中的官能团名称为 。
(2)反应⑦中物质X的分子式为 ,反应⑧的类型为 。
(3)反应⑤的化学方程式为 。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是 。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为 。
(5)检验反应①进行程度,需要的试剂有_________________。
A.新制的Cu(OH)2悬浊液
B.碘水
C.NaOH溶液
D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
下列表述正确的是
A.次氯酸的电 子式:
子式: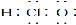
B. 14C的原子结构示意图:
C.188O2- 离子结构示意图: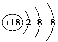
D.CO2的结构式为:O=C=O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东仲元中学高二下期末理综化学试卷(解析版) 题型:简答题
在如图所示均用石墨作电极的电解池中,甲池中为500 mL含某一溶质的蓝色溶液,乙池中为500 mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6 g。请回答下列问题:
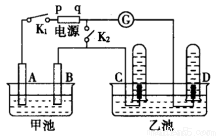
(1)电解过程中,乙池C电极发生反应的电极反应式为______________________。
(2)甲池电解时反应的离子方程式__________________。
(3)甲池电解后溶液的pH=__________,要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________g。(假设电解前后溶液的体积不变)
(4)电解后若再将K1断开,闭合K2,电流计指针发生偏转,则D电极发生反应的电极反应式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com