
| A. | Cl-的结构示意图: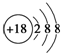 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧化钠的电子式: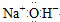 | D. | 铁元素不属于主族元素 |
分析 A.氯离子的核电荷数为17、核外电子总数为18,最外层达到8电子稳定结构;
B.次氯酸分子的中心原子为氧原子,分子中不存在氢氯键;
C.钠离子和氢氧根离子需要用中括号;
D.铁元素属于ⅤⅢ族元素.
解答 解:A.氯离子的核电荷数为17,最外层为8个电子,Cl-的结构示意图为: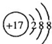 ,故A错误;
,故A错误;
B.次氯酸分子中存在1个氢氧键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故B错误;
C.氢氧化钠为离子化合物,钠离子和氢氧根离子的表示方法不规范,其正确的电子式为: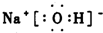 ,故C错误;
,故C错误;
D.金属铁属于ⅤⅢ族元素,不属于主族元素,故D正确;
故选D.
点评 本题考查了化学用语的表示方法,题目难度中等,注意掌握电子式、离子结构示意图、结构式等化学用语的概念及书写原则,试题有利于提高学生的规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
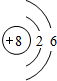 ;③C、D形成的化合物的电子式
;③C、D形成的化合物的电子式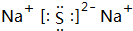 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与溴水发生取代反应 | |
| B. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| C. | 氯乙烷在氢氧化钠的水溶液中生成乙烯 | |
| D. | 将苯、浓HNO3的混合物用水浴加热(60℃左右)制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
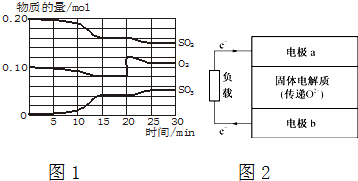
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
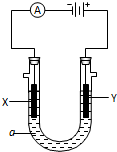 某化学实验小组需要2mol•L-1的NaCl溶液98ml,现用NaCl固体来配制,请回答下列问题:
某化学实验小组需要2mol•L-1的NaCl溶液98ml,现用NaCl固体来配制,请回答下列问题: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com