
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
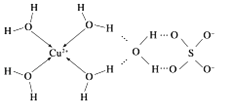
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.
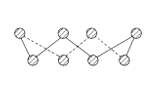
(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____
【答案】M 9 bcd 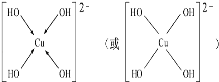 [Cu(H2O)4]SO4H2O 3 sp3杂化
[Cu(H2O)4]SO4H2O 3 sp3杂化
【解析】
(1)基态Si原子的电子排布式是1s22s22p23s23p2,第三层有3s、3p、3d 三个能级;
(2)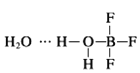 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,根据胆矾结构示意图可知Cu2﹣与H2O通过配位键结合成[Cu(H2O)4]2+。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4。
(1)基态Si原子的电子排布式是1s22s22p23s23p2,电子占据的最高能层为第三层,符号为M,第三层有1个3s轨道、3个3p轨道、5个3d轨道,具有的原子轨道数为9;
(2)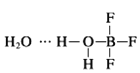 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,结构示意图为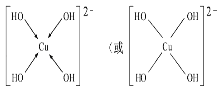 ,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子,第一电离能介于B、N之间的第二周期元素有Be、C、O,共3种;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,S原子杂化方式是sp3杂化。


科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用相应的方程式解释:
(1)NaHSO3溶液显酸性:___________________
(2)NaHCO3溶液显碱性:____________________
(3)NH4Cl溶液显酸性:______________________
(4)明矾[KAl(SO4)2]净水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固体:____________(第一步反应)
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为_______、______(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
下列物质组别中①互为同位素的是___(填组别选项,下同);②互为同素异形体的是___;③互为同分异构体的是___;④属于同一物质的是___;⑤属于同系物的是___。
A.冰与水B.H2、D2、T2C.O2与O3D.![]() K与
K与![]() KE.CH3—CH2—CH2—CH3与
KE.CH3—CH2—CH2—CH3与 F.
F. 与
与 G.甲烷和庚烷
G.甲烷和庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. BOH溶于水,其电离方程式是BOH===B++OH-
B. 若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C. 在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D. 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )
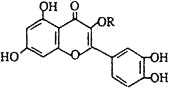
A. 可以使酸性KMnO4溶液褪色
B. 分子中有三个苯环
C. 1mol维生素P可以和4molNaOH反应
D. 维生素P与溴水反应时1mol维生素P可以消耗6molBr2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com