
欲用含有少量氯化钙的氯化钠固体,配制100 mLamol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品mg,在托盘天平左盘上放__________________,右盘上放__________________。
(2)过滤时,漏斗下端管口应________,漏斗中液面应____________________________。
(3)蒸发操作时应将液体放在________中加热,等加热至________________________时停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是_______________,反应的化学方程式是_____________。
(5)在滤液中加入盐酸的作用是________________,反应的化学方程式是 ______________________。
(6)配制100 mLamol/L的NaCl溶液时,应从Wg固体中称取NaCl的质量为________,配制时应在____________________中进行定容。
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:推断题
A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:

(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途 。
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式 。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,该反应的离子方程式 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等
B.等物质的量的N2和CO在标准状况下的体积均为22.4L
C.同温同压下,等体积的物质所含分子数目一定相等
D.1 mol HCl中所含的分子数目和1 L 1 mol/L盐酸中所含的分子数目相同
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验事实陈述正确并且有因果关系的是
A.滴加BaC12溶液生成白色沉淀 原溶液中有SO42﹣
B.用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 原溶液中有Na+无K+
C.滴加氯水和CC14,振荡、静置.下层溶液显紫色 原溶液中有I﹣
D.滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 原溶液中无NH4+
查看答案和解析>>
科目:高中化学 来源:2016届浙江省嘉兴市高三上学期期中测试化学试卷(解析版) 题型:选择题
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示。
可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。
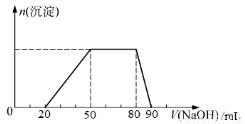
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示。
Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
n(Br-) | 3.0mol | 2.8mol | 1.8mol |
n(I-) | X mol | 0 | 0 |
下列说法中错误的是
A.X=0.3
B.溶液中n(Cl-): n(Br-):n(I-)=10:15:4
C.加入的氢氧化钠溶液的浓度为1.45mol·L-1
D.溶液中大量存在的离子共有六种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:实验题
现有下列仪器:
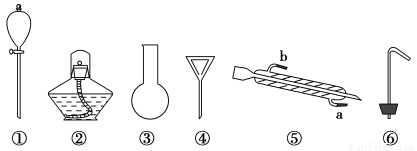
(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是________________(填序号);仪器⑤的冷凝水应从______________口进入(填“a”或“b”)。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的____________(填序号),该仪器名称为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:实验题
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+ H2SO3= MnSO4+H2O)。

①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。

导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42-是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市七校高三上学期期中联考化学试卷(解析版) 题型:推断题
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: 。
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为 。已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式: 。
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式 ; E和氯气接触会产生白烟,利用这一反应,化工厂的工人可用沾有浓氨水的玻璃棒检验输送氯气的管道是否漏气,该反应的化学方程式为
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com