
| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 密度 |
分析 同温同压下,相同物质的量的气体具有相同体积;氢气、臭氧分子中含有原子数分别为2、3,摩尔质量分别为2g/mol、48g/mol;气体密度与摩尔质量成正比,据此进行解答.
解答 解:A.同温同压下,等物质的量的气体具有相同体积,故A正确;
B.1mol氢气(H2)中含有2molH原子,1mol臭氧(O3)气体中含有3molO原子,二者含有原子数不同,故B错误;
C.氢气、臭氧的摩尔质量分别为2g/mol、48g/mol,1mol氢气、臭氧的质量分别为2g、48g,二者质量不同,故C错误;
D.气体密度与摩尔质量成正比,二者的摩尔质量不同,则其密度不同,故D错误;
故选A.
点评 本题考查了阿伏伽德罗定律及推理的应用,题目难度不大,明确阿伏伽德罗定律的内容为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的关系为解答关键.


科目:高中化学 来源: 题型:解答题
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
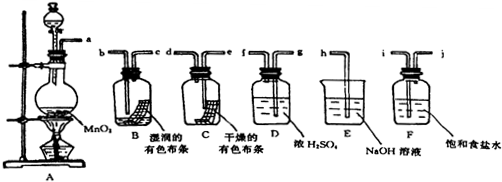
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W | 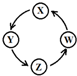 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ②③ | B. | ①③④ | C. | ①④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO${\;}_{2}^{-}$+CO2+3H2O=2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++OH-=BaSO4↓+NH3•H2O | |
| C. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO${\;}_{3}^{-}$=3Fe3++NO↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Ag、Mg、Al | B. | Na、K、Zn、Fe | C. | Zn、Fe、Cu、Ag | D. | Mg、Al、Zn、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
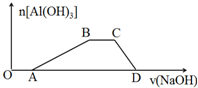 (1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH
(1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com