
| A. | 向NH4HCO3溶液中通入CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| B. | 向Na2SO3溶液通入SO2:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 向CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| D. | 向NH4Cl溶液中通入NH3:c(NH4+)<c(Cl-) |
分析 A.碳酸氢铵溶液中通入二氧化碳气体后,二氧化碳与水反应生成碳酸,碳酸电离出大量碳酸氢根离子,则c(NH4+)<c(HCO3-)+c(CO32-);
B.反应生成亚硫酸氢钠,关键亚硫酸氢钠溶液中的物料守恒判断;
C.反应生成等浓度的醋酸和氯化钠,醋酸部分电离,则c(Na+)=c(Cl-)>c(CH3COOH);
D.反应后溶质为等浓度的氯化铵和一水合氨,溶液显示碱性,根据电荷守恒判断离子浓度大小.
解答 解:A.NH4HCO3溶液中通入CO2,二氧化碳与水反应生成的碳酸能够电离出碳酸氢根离子,导致碳酸氢根离子浓度最大,则c(NH4+)<c(HCO3-)+c(CO32-),故A错误;
B.向含有0.1molNa2SO3溶液通入0.1molSO2,恰好反应生成亚硫酸氢钠,根据亚硫酸氢钠溶液中的物料守恒可知:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)],故B正确;
C.向含有0.1molCH3COONa溶液中通入0.1molHCl,反应生成0.1mol醋酸和0.1molNaCl,钠离子和氯离子不水解,醋酸在溶液中部分电离,则c(Na+)=c(Cl-)>c(CH3COOH),故C错误;
D.含有0.1molNH4Cl溶液中通入0.1molNH3,铵根离子的水解程度小于一水合氨的电离程度,混合液显示碱性,则c(H+)<c(OH-),根据电荷守恒可知:c(NH4+)>c(Cl-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 46.0 | a | b |
| 915 | c | 25.0 | d |
| 1000 | e | f | 15.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
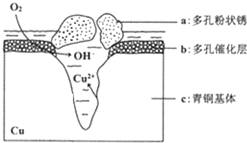 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
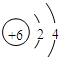 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸、氢氧化钡与盐酸 | |
| B. | 石灰石和硝酸溶液、石灰石与盐酸溶液 | |
| C. | BaCO3与HCl溶液、Na2CO3溶液NaHSO4 | |
| D. | 石灰水中通CO2、石灰水中通SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com