
����Ŀ����һ�������£���һ���������ܱ������г���2mol A��1mol B���������з�Ӧ��
2A��g��+B��g��2C��g����H��0���ﵽƽ�����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ���ǣ� ��
A.����ѹǿ���䣬���߷�Ӧ�¶�
B.�����¶Ȳ��䣬�����������
C.�����¶Ⱥ�����������䣬����1 mol C��g��
D.�����¶Ⱥ�ѹǿ���䣬����1 mol C��g��
���𰸡�D
���������⣺A���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ����淴Ӧ���ʶ��������淴Ӧ�������߶���ԭֱ���Ϸ����淴Ӧ������������������Ӧ��������ı���������ƽ�����淴Ӧ�����ƶ�����A����
B�������¶Ȳ��䣬����������������������ڼ�Сѹǿ�����淴Ӧ���ʶ���С�������淴Ӧ�������߶���ԭֱ�ߵ��·�������Ӧ���ʼ�С�ı��������淴Ӧ���ʼ�С�ı���������ƽ�����淴Ӧ�����ƶ�����B����
C�������¶Ⱥ�����������䣬����1molC��g����˲�䣬���������Ũ�������������������Ũ�Ȳ��䣬�����淴Ӧ���ʴ�������Ӧ���ʣ�������Ӧ������ԭ�����нӴ��㣬��C����
D�������¶Ⱥ�ѹǿ���䣬����1molC��g����˲�䣬����������������������Ũ������Ӧ���Ũ�ȼ�С���淴Ӧ���ʴ�������Ӧ���ʣ�ƽ�����淴Ӧ�����ƶ�����D��ȷ��
��ѡD��
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ����������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
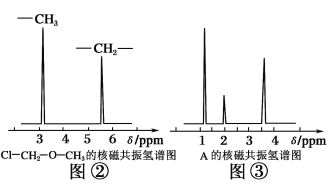
����Ŀ��Ϊ�ⶨij�л�������A�Ľṹ����������ʵ�飺
(һ)����ʽ��ȷ����
(1)���л���A�����������г��ȼ�գ�ʵ���ã�����5.4 g H2O��8.8 g CO2����������6.72 L(��״����)����������и�Ԫ�ص�ԭ�Ӹ�������_________________��

(2)�������Dzⶨ���л����������Է����������õ���ͼ����ʾ����ͼ��������Է�������Ϊ________�������ʵķ���ʽ��________��
(3)���ݼۼ����ۣ�Ԥ��A�Ŀ��ܽṹ��д���ṹ��ʽ________��
(��)�ṹʽ��ȷ����
(4)�˴Ź��������ܶ��л�������в�ͬλ�õ���ԭ�Ӹ�����ͬ�ķ�ֵ(�ź�)�����ݷ�ֵ(�ź�)����ȷ����������ԭ�ӵ��������Ŀ�����磺���ȼ���(Cl��CH2��O��CH3)��������ԭ����ͼ�ڡ����ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ�ۣ���A�Ľṹ��ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС����Ͷ��ʢ20 mL����ͭ��Һ���ձ�������ܹ۲쵽��������
A. ���۳�С���Ĵ��ζ� B. �Ƹ���Һ����
C. ��Һ�ײ��к�ɫ�������� D. ���ι����·�����ɫ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͼΪ�����Ŀռ�ṹ(̼��)��
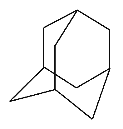
����һ�ȴ�����________�֣����ȴ�����________�֡�
(2)���fӢ��һ����и߶��Է����廯������ܳƣ���ĸ��ṹ��ͼ��
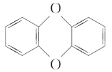
����֪�����ʵ�һ�ȴ����ж��֣�������ʵ�������ﹲ��________�֣�
�ڸ����ʵĶ���ȡ���ﹲ��________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����������У������¸�������������������ʵ�����á�ƫ�ߡ���ƫ�͡�����Ӱ�족����գ���
(1)�ζ���������ˮϴ����δ����֪Ũ�ȵı���Һ��ϴ��ʹ�ζ���� ��
(2)��ƿ������ˮϴ�������ô�����Һ��ϴ��ʹ�ζ���� ��
(3)�ζ���(װ����Һ)�ڵζ�ǰ���촦�����ݣ��ζ�������������ʧ��ʹ�ζ���� ��
(4)�ζ�ǰƽ�ӣ��ζ��յ㸩�ӵζ��̶ܿ� ��ʹ�ζ���� ��
(5)��NaOH��Һ�ζ�����(��̪��ָʾ��)��������һ��NaOH��Һʱ��Һ��dz��ɫ����ʱ��ֹͣ�ζ���ʹ�ζ���� ��
(6)�ú�Na2O���ʵ�NaOH������������֪Ũ�ȵı���Һ�����ڵζ�δ֪Ũ�ȵ����ᣬʹ��������Ũ�� ��
(7)�ú�Na2CO3���ʵ�NaOH������������֪Ũ�ȵı���Һ�����ڵζ�δ֪Ũ�ȵ����ᣬʹ��������Ũ�� ��
(8)ϴ����ƿʱ�����ϡʳ��ˮ��������ˮ��Ȼ������ƿװ��������ᣬ��NaOH����Һ�ζ�ʱ���Բ�õĽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ư�۵�������ȷ����()
A.Ư�۵���Ч�ɷ���Ca(ClO)2��CaCl2B.Ư���ڿ����о��ú�����
C.Ư�۵���Ч�ɷ�Ca(ClO)2���ȶ�,�ֽ�D.Ư�۵���Ҫ�ɷ���CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�棬101k Paʱ����֪���п��淴Ӧ���ʱ�ͻ�ѧƽ�ⳣ���ֱ�Ϊ��
A��g��+2B��g��2C��g��+2D��l����H=��250kJmol��1 K=0.2L/mol
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ�� ��
��2���÷�Ӧ���淴Ӧ�ġ�H= �� �÷�Ӧ���淴Ӧ��K= ��
��3���Ը÷�Ӧ���ԣ������¶ȣ�ƽ�ⳣ����������ѹǿ��ƽ�ⳣ���� �� �����������С�����䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL 0.50mol/L������50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ 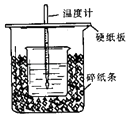
��1���۲�ʵ��װ�ã�ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� ��
��2�����ձ����粻��Ӳֽ�壬��õ��к��ȵ���ֵ���ƫ����ƫС������Ӱ�족����
��3��ʵ������е���NaOH��Һ����ȷ������ ��
a���ز������������� b���ֶ���������� c��һ��Ѹ�ٵ���
��4��ʵ���и���55mL 0.50mol/L������55mL 0.55mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ�����ȡ�����������к��������ȡ�����ȡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ8NH3��3Cl2=N2��6NH4Cl����������NH3�뱻��ԭ��Cl2�����ʵ���֮��Ϊ�� ��
A.3��2B.8��3C.6��3D.2��3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com